中国化粧品新原料の申告
「化粧品衛生監督条例」(衛生部令第3号)、化粧品新原料とは、中国国内で初めて化粧品の製造に使用される天然または人工原料である。新原料を使用する前に、申告をしなければならない。その成分により、化学品法規制を遵守する要求もある。
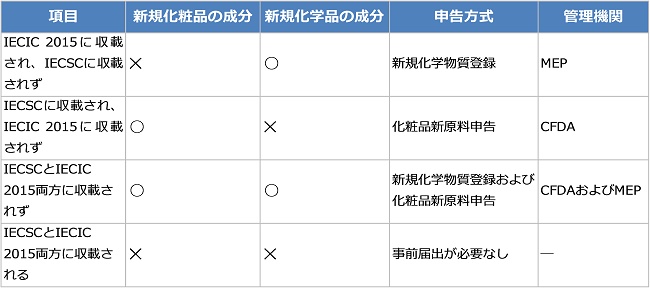
新原料成分の判定
毒理学試験書類
2011年に公布された「化粧品新原料の申告および技術評価審査に関する指南」によると、化粧品新原料に対して、通常以下の毒理学評価書類が提出しなければならない。なお、海外の国や地域の報告書を提出する場合には(GCPまたはGLP)、オリジナル報告書または公証した書類も提出必要がある。
- 急性経口および急性経皮毒性
- 皮膚および急性眼刺激性/腐食性試験
- 皮膚感作性試験
- 皮膚光毒性および光感作性試験(紫外線吸収特性を持つ原料のみ)
- 変異原性試験(少なくとも遺伝子変異原性および染色体異常試験を含むべき)
- 亜慢性経口および経皮毒性試験
- 催奇形性試験
- 慢性毒性/発がん性合併試験
- 毒物代謝および薬物動態試験
- 原料の特性および用途に基づいて、ほかの必要な試験の追加を考慮する。該当新原料がすでに化粧品に使用されたことがある原料の化学構造および特性と類似する場合は、一部試験を軽減する可能性がある。
軽減基準 軽減可能な試験 (1)防腐剤、日焼け止め剤、着色剤、染毛剤に使用しない原料 (2)および安全面から考慮すると、「化粧品衛生規範」使用制限物質リストに納入不要の化粧品新原料 7,8,9,暴露経路による亜慢性経口および経皮毒性試験の提出書類を決定 (3)上述の(1)+(2)に合致し、且つ海外の国や地域の権威機関の化粧品原料インベントリーに4年以上収載されている (4)人体の健康に危害を及ぼす可能性に関する公的文献がなし 6,7,8,9 (5)食用の安全履歴があり、政府や権威機関が公布したもの、または安全性評価による安全な食品原料およびその抽出物とみなされた 1,5,6,7,8,9 (6)相対平均分子量が1,000ダルトン以上のポリマー 1,3,5,6,7,8,9および光感作性試験 (7)海外の国や地域の権威機関の評価結果により、化粧品に使用する安全な新原料であると認められている 1,2,3,4,5,6,7,8,9
申告書類
1 | 化粧品新原料行政許可申請表 |
2 | 研究開発報告書 ―原料開発の背景、過程および関連技術書類 ―原料の名称、由来、相対分子量、分子式、化学構造、物理/化学特性 ―化粧品における原料の使用目的、使用範囲、安全な使用制限量とその根拠、注意事項、警告など ―原料は海外の国や地域で使用されたことがあるか否かに関する説明 |
3 | 製造プロセスに関する簡潔な説明および簡略図 |
4 | 原料の品質安全コントロールに関する要求 |
5 | 毒理学安全性評価書類 |
6 | 輸入化粧品新原料の申告人は、登録済みの行政許可在華申請責任機関授権書の副本および押印済みの行政許可中国における申請責任機関営業許可証の副本を提出しなければならない |
7 | 行政許可申請に役立つほかの書類 |
化粧品新原料は、製造または使用プロセスで人体に危害を及ぼす可能性がある。化粧品新原料に対する評価審査原則によると、申告人が提出する書類の安全性、科学的合理性について評価審査を行わなければならない。中国国家食品薬品監督管理局(CFDA)によると、化粧品新原料の申告者が法的責任を負う。
化粧品新原料毒理学評価書類には、毒理学安全性評価の概要、必要な毒理学試験書類および安全性でリスクを伴う可能性がある物質に関する安全性評価書類が含まれる。
- 物理化学特性、純度、不純物の種類およびその含有量などに関するデータ
- 化粧品新原料の由来(複合配合、動物、植物など)
- 植物から抽出段階での農薬残留およびほかの不純物
- 成分およびリスク物質の毒理学評価書類(IRAC発がん性物質に分類されるか否か)
- 化粧品原料、化粧品製品、食品、空気、水(状況により)のリスク物質に関する公的文献または国際な法規制における制限概要
- 化粧品原料および製品のリスク物質の濃度、定性的評価、定量評価および関連公的文献
- 有害性評価、用量反応評価(必要な場合には、NOAELで計算)および暴露評価
- 成分およびリスク物質の安全性または暴露マージンの計算(必要に応じて)
2015年11月10日、CFDAによる「化粧品安全リスク評価指南」(意見募集稿)を公布した。同指南は、EUの化粧品安全評価ガイドラインを参考し、化粧品原材料のリスク評価および安全評価の参考標準として作成られた。
申告費用
申告費用には、評価費用とコンサルティング費用が含まれる。
- 海外の国や地域の権威機関の評価結果により、化粧品に使用する安全な新原料であると認められている、中国での毒理学評価データが必要がない場合には、申告ドシェ、リスク評価報告書、結論、承認書類およびほかの関連書類が提出しなければならない。申告費用は約150,000-250,000RMB(コンサルティング費用を含む)。
- すべての毒理学試験を行わなければならない場合には、申告費用は約800,000-1,000,000RMB(評価費用とコンサルティング費用を含むが、行政費用が含まず)
化粧品新原料の承認行政手続
CFDAによる提出された書類審査する。
- 完全性審査 5日間
- 技術評価審査 3ヶ月
- 承認通知或いは指摘通知 20日間
CIRSの化粧品チームは、長期にわたり中国化粧品法規制を研究し、化粧品・化粧品新原料申告の実績があり、専門な経験を活かしてお客様に化粧品対応サービスを提供いたします。
- 化粧品および化粧品原料法規制のコンサルティング
- 中国化粧品登録(輸入、国産)
- 中国化粧品新原料の申告代行業務
- 毒理学安全評価
- 配合およびラベル審査
- ほかの国や地域の化粧品登録(韓国、ASEANなど)
- 輸入化粧品の通関審査
お問い合わせ
service@cirs-group.com



