中国国家市場監督管理総局(SAMR)が2021年2月1日に公表された「コエンザイムQ10等5種の保健食品原料届出製品剤形及び技術要求」に関する解読に基づき、コエンザイムQ10、壊れた壁霊芝胞子粉末、スピルリナ、魚油、メラトニンを単一原料とする保健食品の届出申請は国産保健食品のみに適用し、初回輸入の保健食品に適用しません。現時点、初回輸入のこの5種の保健食品製品は相変わらず「保健食品登録及び届出管理弁法」に基づき、国家市場監督管理総局に登録申請しなければなりません。
相関企業が製品の中国市場進入する過程中の区別をしっかり把握できることを目的として、CIRSは輸入保健食品の登録申請と届出申請の区別を整理して分析いたします。
1. 申請範囲の区別
現時点、「中華人民共和国食品安全法」及び「保健食品登録及び届出管理弁法」の相関規定に基づき、初回輸入の保健食品の登録と届出の申請範囲は以下の通りです。
● 届出:ビタミン・ミネラルなどの栄養物質を補充し、しかも、「保健食品原料目録 – 栄養素補助剤(2020年版)」の要求に合致する保健食品(つまり、栄養素補助剤サプルメントは届出申請する)
● 登録:栄養素補助剤サプルメント以外、その他の保健食品(つまり、機能性保健食品は登録申請する)
2. 所要試験の区別
届出申請に比べて、登録申請の所要試験の項目は多いです。詳細は以下の通りです。
登録申請の所要試験 | ● 製品技術要求に従い全項目検査(3ロット) ● 効能成分又は特性成分、衛生学検査、安定性試験(3ロット) ● 毒性学試験(1ロット) ● 動物効能試験及び(或は)対象者の実際食用試験(1ロット) ● 効能成分又は特性成分の方法学検証 ● その他の必要な試験 |
届出申請の所要試験 | ● 製品技術要求の全項目検査(3ロット) ● 製品の効能成分或は特性成分、衛生学検査、安定性試験(3ロット) ● 効能成分又は特性成分の方法学検証(必要であれば) |
また、コエンザイムQ10等5種の原料を単一原料とする保健食品の場合、国産製品は届出申請可能ですが、輸入製品は登録申請しなければならなくて、以下より多くの試験を進行しなければなりません。
● コエンザイムQ10(免疫力増強):毒性学試験、動物効能試験
● コエンザイムQ10(抗酸化):毒性学試験、動物効能試験、対象者の実際食用試験
● 魚油(血脂低下):毒性学試験、動物効能試験、対象者の実際食用試験
● メラトニン(睡眠改善):毒性学試験、動物効能試験
● 壊れた壁霊芝胞子粉末(免疫力増強):毒性学試験、動物効能試験
● スピルリナ(免疫力増強):毒性学試験、動物効能試験
3. 申請資料の区別
提出すべきな試験報告が違う以外、申請資料の方面に保健食品登録申請と届出申請の最も主要な区別は、登録申請は完備的な製品研究開発報告を提出しなければなりません。それに対し、届出類製品は原料から製品まで全ての要求は規範化、標準化されるので、製品の研究開発報告を提出する必要がありません。
コエンザイムQ10等5種の原料を単一原料とする輸入保健食品は、登録申請を提出する際に製品の研究開発報告を提出する必要です。ただし、コエンザイムQ10等5種の原料は中国における既に長期的な食用歴史があり、配合処方の研究も成熟であり、しかも、既に「保健食品原料目録」に収載されているので、「コエンザイムQ10等5種の保健食品原料目録」及び「コエンザイムQ10等5種の保健食品原料届出製品剤形及び技術要求」は製品研究開発報告の最も主要な根拠として使用可能です。つまり、その他の輸入機能性保健食品に比べて、コエンザイムQ10等5種の原料を単一原料とする輸入保健食品の製品研究開発報告の編集や作成はかなり容易的です。
項目 | 登録申請 | 届出申請 |
申請資料要求の区別 | 完備的な製品研究開発報告を提出すべきです。詳細は以下の通りです。 ● 安全性論証報告 ● 保健効能論証報告 ● 製造工程研究報告 ● 製品技術要求研究 | 製品研究開発報告を提出不要です。 |
4. 許認可申請流れの区別
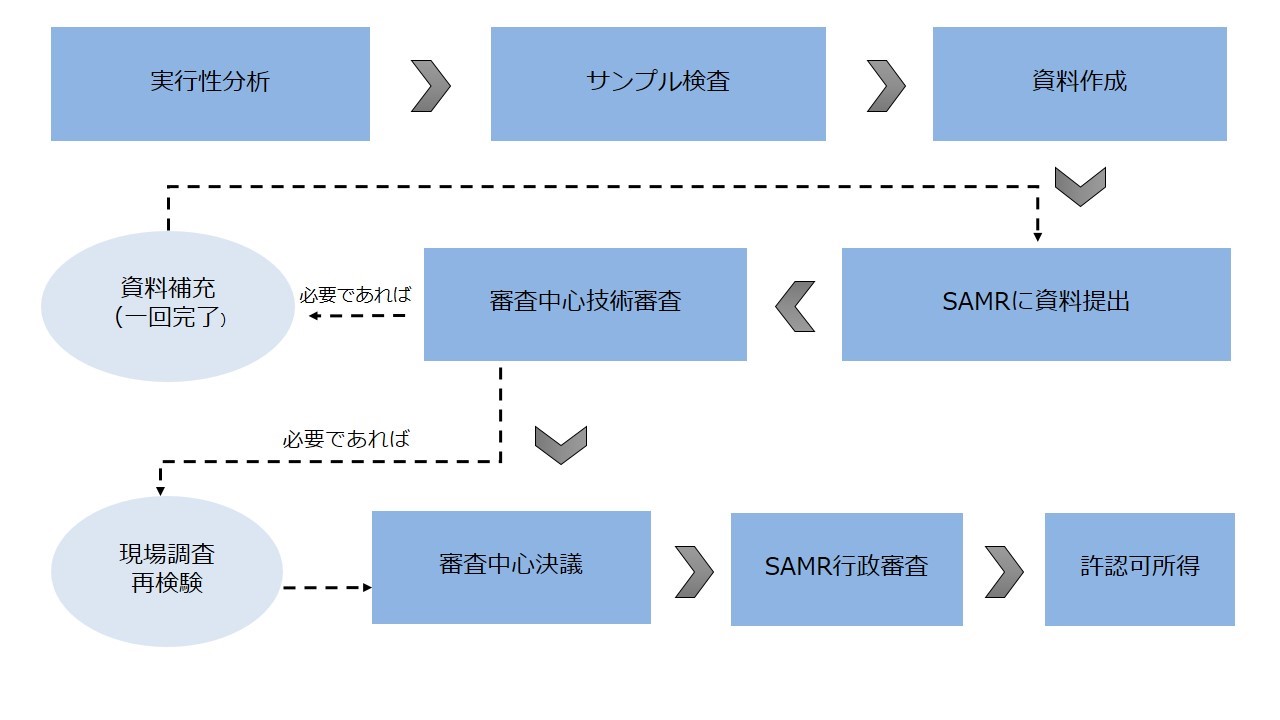
● 輸入保健食品登録申請の流れ
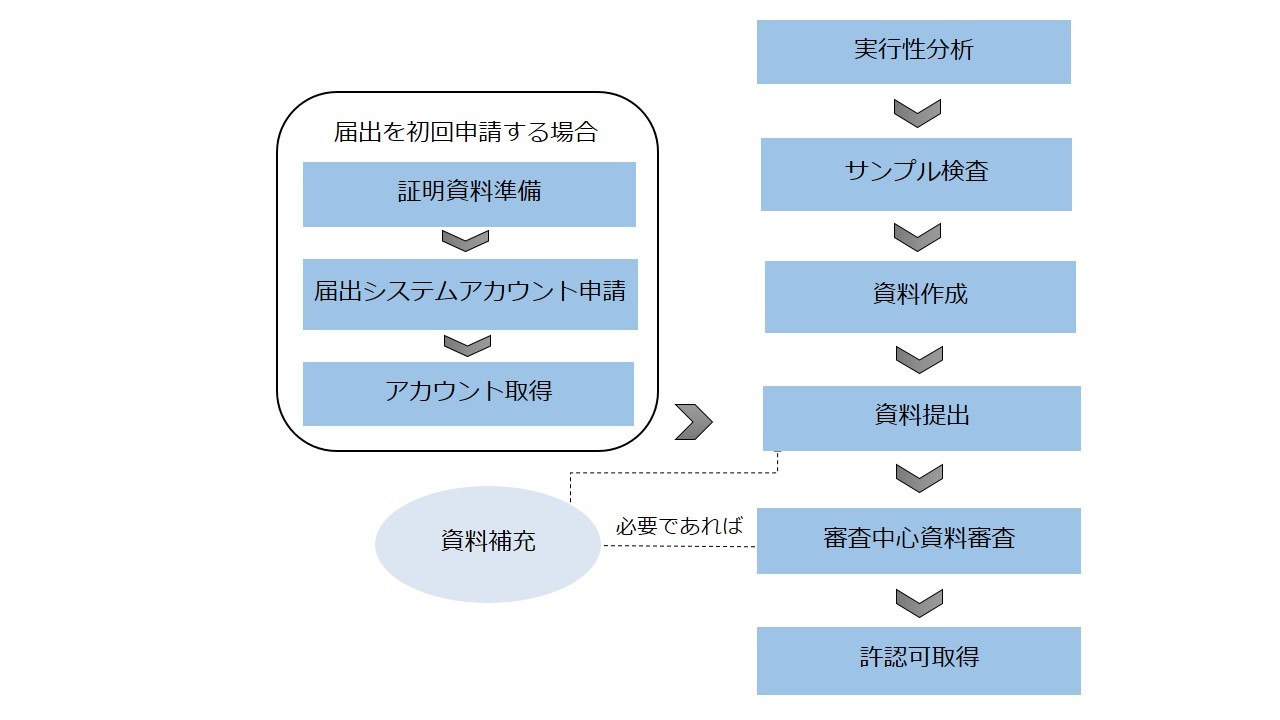
● 輸入保健食品届出申請の流れ
上述した説明の通りに、申請流れ方面に輸入保健食品の登録申請と届出申請は主に四つの区別があります。
区別 | 登録申請 | 届出申請 |
システムアカウント申請 | 相関情報を記入すると登録システムアカウントを即時に取得でき、人工審査は不要。 | 届出を初回申請する場合、企業は「申請企業資格証明資料」、「連絡人授権書」、「法人パスポート」という三つの資料を準備して、食品審査評価中心に届出システムアカウントを申請し、食品審査評価中心の人工審査を通過した後に、アカウントを取得する。 |
専門家技術審査 | 専門家技術審査を通過すべき、具体的には以下を含む。 ● 安全性専門家の審査評価 ● 保健効能専門家の審査評価 ● 製造工程専門家の審査評価 ● 製品技術要求専門家の審査評価 | 専門家技術審査は不要であり、食品審査評価中心の先生は届出申請資料を審査する。 |
現場調査及び再試験 | 技術審査の結果に基づき、必要であれば進行する。 | 不要 |
SAMR行政審査 | 必要。SAMRは行政審査を進行し、認可された後に許認可を取得する。 | 不要 |
5. 所要周期の区別
上述した試験要求、申請資料要求、申請流れなどの方面の区別に基づき、所要周期方面に、輸入保健食品の登録申請と届出申請の区別は以下の通りです。
主要流れ | 推定周期(輸入保健食品の登録申請) | 推定周期(輸入保健食品の届出申請) |
申請の実行性分析 | 7就業日 | 3就業日 |
申請企業サンプル準備 | 申請企業の状況によって決定 | 申請企業の状況によって決定 |
試験検測 | 8-16ヶ月 (製品の保健効能によって決定) | 4ヶ月 |
申請資料の作成及び提出 | 2ヶ月 | 1ヶ月以内 |
受理機構受理 | 5就業日以内 | / (オンライン提出のみ) |
専門家技術審査(或は) 食品審査評価中心資料審査 | 60就業日以内 | 普通は1-2ヶ月 |
資料補充 (必要であれば) | 3ヶ月以内 | 補正要求によって決定 (一般的に、1ヶ月以内) |
技術再審査/資料再審査 | 60就業日以内 | 普通は1-2ヶ月 |
現場調査及び再検験 (必要であれば) | 具体的な状況によって決定(輸入製品) 90就業日以内(国産製品) | / |
審査中心結果をSAMRに引継ぎ | 5就業日以内 | / |
SAMR行政審査、認可決定 | 20就業日以内 | / |
認可決定を受理機構に引継ぎ | 3就業日以内 | / |
受理機構許認可発出 | 10就業日以内 | 届出システムは直接に発出 |
総計 | 15ヶ月以上 | 8-10ヶ月 |
届出申請の所要周期に比べて、登録申請の所要周期は更に長いです。また、コエンザイムQ10、壊れた壁霊芝胞子粉末、スピルリナ、魚油、メラトニンを単一原料とする輸入保健食品の登録申請は、製品配合が簡単的且つ成熟的であり、安全性も既に十分的に論証されましたので、申請資料の作成、専門家技術審査、資料補充などのステップはその他の登録類保健食品より順調的で、時間も節約できるはずだと考えられ、15ヶ月ぐらいに許認可を取得できる見込みです。
一方、輸入保健食品届出申請の所要周期は以下二つの方面に影響されます。まず、輸入保健食品の届出を初回申請する企業は届出システムアカウントを取得しなければなりません。一般的に、食品審査評価中心は企業のアカウント申請を受理した後に、1ヶ月以内に結果を出します。実は、輸入保健食品届出システムアカウントの申請は一定的な難度がありますので、申請企業が相関要求をしっかり把握できないと、1年以上の時間を掛かってアカウントを申請する恐れがあります。ですので、届出システムアカウントの申請はできるだけ速めに開始すべきだと思っております。また、輸入保健食品の届出申請資料は食品審査評価中心の審査を通過しなければなりません。このステップの周期について、法規制は具体的に規定していないですが、一般的に、1-2ヶ月の時間が掛かります。
6. まとめ
上述した説明の通りに、輸入保健食品の登録申請と届出申請は「申請範囲」、「試験要求」、「申請資料要求」、「申請流れ」などの方面に要求は違いますので、申請の所要周期及び所要費用もかなり大きな差異を示します。勿論、届出申請に比べて、登録申請の所要周期は長くて、所要費用も高いです。
ただし、コエンザイムQ10、壊れた壁霊芝胞子粉末、スピルリナ、魚油、メラトニンを単一原料とする輸入保健食品なら、それも違います。上述した説明の通りに、この5種の製品の研究開発報告の準備は簡単的で、しかも、届出システムアカウントに比べて登録システムアカウントの取得はとても容易的です。ですので、要求に合致している製品があれば、現時点に登録申請を提出して、輸入製品の市場を先取りすることはよい選択だと思っております。



