化粧品の定義および分類
中国「化粧品衛生監督条例」(衛生部令第3号)によると、化粧品とは、塗布、噴射、或はその他の類似する方法により、人体(皮膚、毛髪、爪、唇など)に散布し、清潔、体臭の緩和、スキンケア、美容および修飾を目的とする日常用化学工業製品を指す。
注:「化粧品監督管理条例」修正草案によると、化粧品とは、塗布、噴射、或はそのほかの類似する方法により、人体(皮膚、毛髪、爪、唇など)、歯および口腔粘膜に使用し、清潔、保養、美化、修飾および良好な状態を保つことを目的とする製品を指す。
中国で化粧品は「特殊用途化粧品」と「非特殊用途化粧品」に分けられています。
類別 | 許可方式 | 申告人 | 管理機関 | |
国産非特殊用途化粧品 | ヘアケア、スキンケア、メイクアップ、ネイルケア、芳香の5種類 | 届出証明書 | 中国における製造者またはブランド所有者 | 省級FDA |
輸入非特殊用途化粧品 | 届出証明書 | 指名された中国における申告企業 | CFDA | |
国産特殊用途化粧品 | 育毛用、染髪用、パーマネント用、脱毛用、バスト用、シェイプアップ用、消臭用、シミ取り用、日焼け止め用の9種類 | 行政許可証 | 中国における製造者またはブランド所有者 | CFDA |
輸入特殊用途化粧品 | 行政許可証 | 指名された中国における申告企業 | CFDA | |
化粧品またはその新原料を中国(中国大陸)で製造または輸入する場合には、中国国家食品薬品監督管理局(CFDA)の承認を得て、「化粧品衛生行政許可証」を取得しなければならない(石鹸、歯磨き、オーラルクリーナーが必要なし)。「化粧品衛生監督条例」(衛生部令第3号)の規定により、化粧品衛生行政許可証の有効期限は4年間で、期限延長を申請する手続がある。
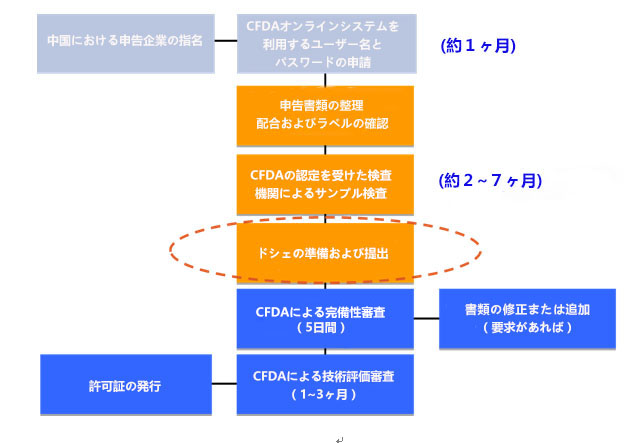
輸入化粧品申告の流れ
注:法律上の義務を付けられないが、商売を順調に進めるために、英語または中国語のブランド名は、商標として登録するほうがお勧めです。
1.中国における申告企業の指名
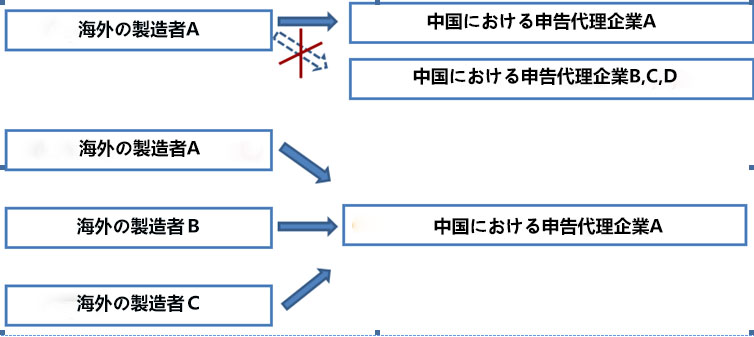
「化粧品行政許可申告受理規定」により、海外の製造者は中国国内における登記された法人格を有する企業を依頼し、申告手続を行わなければならない。申告企業は委託代理証明書でCFDAに許可申請を提出し、申告業務を展開する。申告企業は製品の安全責任を負わないので、ラベル上の表示が必要なし。
申告企業は複数の企業が共同で設立可能が、同一企業は複数の申告企業を指名することができない。
法人格を有する中国における支社、販売業者あるいは第三者(コンサルティング会社)は申告企業に指名されることが可能である。
1) 中国における支社を指名
メリット | 許可証の保有にはリスクがなし |
複数社の販売業者を設立する場合、通関手続がよりスムース | |
ディメリット | 中国で支社を設立する費用が高い |
支社の設立手続が終わるまでには、製品が届出不能 |
メリット | 販売業者による事前届出が対応可能、費用が減少できる |
地元の優勢を利用して、信用できる申告代理企業を探す | |
ディメリット | 販売業者は申告費用を支払うまたは分担すると、海外の製造者による許可証の保有が困難 |
販売業者の変更が困難 | |
全部の申告書類は責任者による押印が必要なので、製品の配合、製造プロセスなどの秘密情報が漏らす可能性がある |
メリット | 海外の製造者による許可証を保有 |
経験豊富で専門知識があり、時間とコストが削減できる | |
ディメリット | コンサルティングサービスは経済発展の産物である。中国におけるコンサルティング機構の成長がアンバランス、且つ中国に登記された法人格を有するという資格だけを要求されるなので、コンサルティングの選択を注意しなければならない。 |
2.ユーザー名とパスワードの申請
化粧品を申告する前、CFDAオンライン申告システムを利用するために、中国における申告企業によるユーザー名とパスワードを申請しなければならない。なお、押印済み委託代理証明書と営業許可証を提出必要となる。
3.製品の配合
化粧品の配合には、INCI名(化粧品原料国際命名法)、中国の標準名、成分の濃度および効能などが表示すべきである。使用禁止成分を含むまたは「化粧品衛生規範(2007年版)」の制限条件を満たさない場合、CFDAによる拒否される。なお、新規成分を含むと、その新規成分はCFDAの許可を得なければならない。
4.製品の包装
化粧品の包装には、名称、原料リスト、製造者などの情報を表示しなければならない。化粧品命名規定およびその命名ガイドラインによると、虚偽誇張と絶対的な言葉、医療専門用語、医療作用や効果を明示するまたは暗示する用語の使用は禁止される(例、抗菌、成長因子、幹細胞、最高位など)。CFDAに申告を提出する前に、製品の包装を審査しなければならない。
5.試験要求
化粧品の検査または試験がCFDAの認定を受けた検査機関で行う要求がある。検査項目には、衛生化学検査、微生物検査および毒理学評価などがあり、非特殊用途化粧品がその書類を提出しなければならない。特殊用途化粧品に対して、ほかの人体に対する安全性試験が要求される。製造プロセスにおける原料には人の健康に危害を及ぼす可能性がある成分を含むと、追加試験が要求される。(CFDAによる認定された検査機関の中には、衛生化学検査を行うのが21、人体に対する安全性試験を行うのが6)
中国で動物実験による毒理学評価を行うのが普通であるが、2014年6月30日から、国産非特殊用途化粧品の動物実験の要求が変更された。動物実験の代わりに、既存の原材料安全試験データを利用できれば、またはEUの動物を用いない試験方法でデータを得ることができれば、動物実験が回避可能と調整られた。クルエルティフリーの海外の製造者にとって、製品を中国に輸出し、中国で包装されると、国産化粧品と見なされるようになる。なお、クロスボーダー(越境)ECで化粧品を販売すると、動物実験の回避も実現できる。
6.申告書類
輸入非特殊用途化粧品
- 輸入非特殊用途化粧品の行政許可申請表
- 製品の中国語の命名根拠
- 製品の配合
- 製品の品質安全コントロールに関する要求
- 製品オリジナル包装(製品のラベル、説明書を含む)
- CFDAの認定を受けた検査機関による発行された検査報告書およびその関連書類
- 製品における危害を及ぼす可能性がある物質に関する安全性評価書類
- 中国における登記された申告企業への委託代理証明書の写しおよびその営業許可証の写し(会社印を押印済み)
- 化粧品の原料および原料の提供元が狂牛病の発生地域の高危険物質利用禁止または制限要求に合致する保証書
- 製品の製造国(地域)における製造、販売証明文書
- 製造プロセスに関する簡潔な説明および簡略図
- 製品の技術要求
- 行政許可申請に役立つほかの書類
注:特殊用途化粧品はほかの追加書類が要求される
7.CFDA審査
CFDAによる完備性審査および技術評価審査を実施する。毎月1回の定例会議で、特殊用途化粧品の技術評価審査を行う。非特殊用途化粧品の場合、定期な審査評価会議が行わない。通常、完備性審査は5日間をかかり、技術評価審査は約3ヶ月をかかる。CFDAによる発行された許可証は、通関手続をする必要があり、その番号を中国語のラベルに表示すしなければならない。
8.申告期間および費用
種類 | 申告期間 | 申告費用(RMB per type) |
輸入非特殊用途化粧品 | 6~8ヶ月 | 約12,000-18,000 |
輸入特殊用途化粧品 | 9~14ヶ月 | 約19,000-80,000 |
注:新原料またはリスク物質を含むと、追加試験が要求される。
9.通関手続
CFDAによる許可された海外の製品を中国に輸出する場合、輸入業者が検査検疫機関(CIQ)に申告を提出しなければならない。許可証の写し、製品の配合、サンプル、中国語ラベルの内容見本、オリジナルラベルおよび翻訳版などの書類が要求され、検査検疫機関でサンプリング検査を受けなければならない。なお、検査検疫機関は「消費者製品使用説明 化粧品通用ラベル」(GB 5296.3-2008)を参考し、製品のラベルを検査する。検査検疫証明書を取得した製品は、輸入業者による通関手続を行うことになる。
CIRSの化粧品チームは、長期にわたり中国化粧品法規制を研究し、化粧品・化粧品新原料申告の実績があり、専門な経験を活かしてお客様に化粧品対応サービスを提供いたします。
- 化粧品および化粧品原料法規制のコンサルティング
- 中国化粧品登録(輸入、国産)
- 中国化粧品新原料の申告代行業務
- 毒理学安全評価
- 配合およびラベル審査
- ほかの国や地域の化粧品登録(韓国、ASEANなど)
- 輸入化粧品の通関審査
お問い合わせ
service@cirs-group.com



