「現場調査」は特殊医学用途調整食品(FSMP)が中国市場に進入する前の必要なステップであり、申請企業がFSMP製造企業とする資格の有無を判定する重要な根拠として、当局は申請企業に対して厳格的に審査します。中国のFSMPは全新的な食品類別であり、その管理制度の施行は5年未満となり、第1件の許認可取得も3年未満です。従いまして、FSMPの「現場調査」に対して分からない企業が多いです。この度、CIRSは相関規制及び標準に基づき、FSMPの「現場調査」に対して紹介いたします。
FSMP現場調査の分類
「中華人民共和国食品安全法」、「特殊医学用途調整食品登録管理弁法」及び「食品生産許可審査通則」に基づき、FSMP現場調査は以下に分けられます。
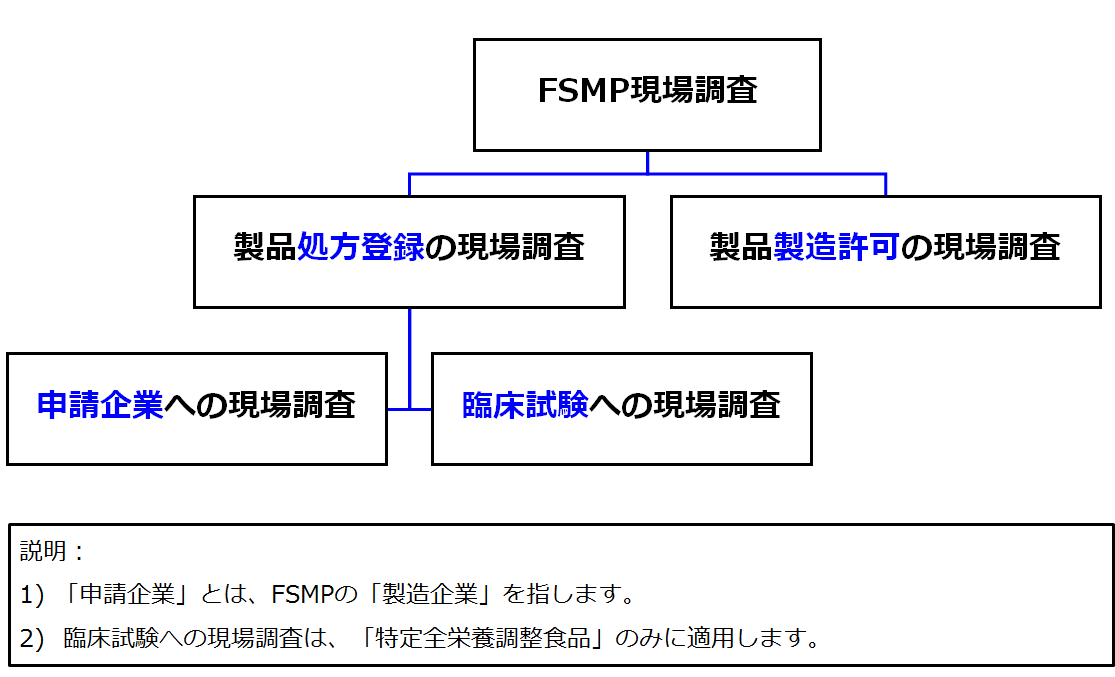
製品処方登録の現場調査
1. 審査を実行する機構
「特殊医学用途調整食品登録管理弁法」(以下は、「管理弁法」と略称する)に基づき、中国国家食品薬品監督管理総局審査機構(現在は、「中国国家市場監督管理総局食品審査評価中心」に変更)は特殊医学用途調整食品の製品処方登録に関する現場調査を行い、申請企業ローカルの省レベル食品薬品監督管理機構に現場調査の参加を通知します。つまり、FSMP製品処方登録の現場調査は、国が実行し、省が参加します。
2. 現場調査の時間
「管理弁法」に基づき、
1) 審査実行機構は審査評価中心の通知を受けた後、20就業日以内に申請企業への現場調査を完成し、審査報告を出します。
2) 審査実行機構は審査評価中心の通知を受けた後、40就業日以内に臨床試験への現場調査を完成し、審査報告を出します。
3. 現場調査の審査項目
現場調査は「特殊医学用途調整食品登録製造企業現場審査要点及び判断原則(試行)」(以下は、「審査要点及び判断原則」と略称する)に基づいて実行し、以下8つの部分に分けられます。
製造能力、研究開発能力、試験能力、製造現場、設備施設、人員、原料管理、製造過程管理
また、上述した8部分は更に24項目に分けられます。中に、肝心な審査項目は5つがあります。
製造企業資格、研究開発能力、製造品質管理体系、製造条件、製造用水
その同時、技術審査評価の必要性に基づき、申請企業が提出した申請資料に関わるその他の項目について現場調査を進行することもできます。
臨床試験の現場調査について、「管理弁法」は「臨床試験の真実性、完備性、正確性などの状況に対して現場調査を行う」だけを説明し、より具体的な規定がありません。
4. 現場調査の判定根拠
上述した24項目の中に、5つの肝心な審査項目の審査結果は「適合」と「不適合」に分け、残された19項目の一般審査項目の審査結果は「適合」、「基本適合」と「不適合」に分けられます。審査結果の状況に基づき、以下の審査決定に分けられます。

「改革」は10日以内に完成しなければなりません。申請企業改革完了後、ローカルの省レベル食品安全監督管理機構は審査して確認し、承認します。その後、審査実行機構は「現場調査通過」の決定を出します。
製品製造許可の現場調査
1. 審査の実行機構及び審査時間
「食品生産許可管理弁法」に基づき、特殊医学用途調整食品製造許可の審査は、省レベルの市場監督管理機構が行います。「食品生産許可審査通則」(以下は、「審査通則」と略称する)に基づき、申請企業日常の食品安全監督管理機構は観察員を派遣して現場調査を参加しながら、審査グループのメンバーとしなくて、評価及び審査結果の判定にも参与しません。観察員が現場調査の手順、過程、結果に対して異議ある場合、現場調査終了後3就業日以内に許可機構に提出することができます。つまり、FSMP製造許可の審査は、省レベルの市場監督管理機構が行い、申請企業日常の食品安全監督管理機構は参加し、監督します。
「審査通則」に基づき、審査実行機構は現場調査任務を受けた後、10就業日以内に現場調査を完成しなければなりません。
2. 現場調査の審査項目及びその審査方法
「審査通則」に基づき、製造許可の現場調査は製造場所、設備施設、設備配置及び工程流れ、人員管理、管理制度及びその執行状況、試製造製品検査合格報告の確認という6つの部分に分けられます。そして、「特殊医学用途調整食品生産許可審査細則」(以下は、「審査細則」と略称する)は、特殊医学用途調整食品に適用させるために、この6つの部分に対して細則化して補充説明します。
3. 現場調査の判定根拠
食品製造許可の現場調査は、「食品、食品添加剤生産許可現場審査評価記録表」(以下は、「評価記録表」と略称する)という点数記録表があります。「評価記録表」は上述した6つの部分を34項目の審査項目に分けます。中に、
1)「試製造製品検査合格報告の確認」部分は単独的に一つの項目として、その得点基準を「1点、0.5点、0点」に設置します。
2)残された5部分は33項目に分けられ、その得点基準を「3点、1点、0点」に設置します。
「評価記録表」に基づき、「0点」と判定される項目がなくて、しかも、総得点率は≥85%である場合、「現場調査通過」と判定します。「0点」と判定される項目があり、又は総得点率は<85%である場合、「現場調査未通過」と判定します。
また、以下状況が有れば、直接に「現場調査未通過」と判定されます。
1)申請企業が現場調査の実行に協力しない
2)現場調査する際に製造設備施設が正常稼働できない
3)申請企業が実情を隠し、或は虚偽申請資料を提供する
4)申請企業の主観原因で現場調査が正常に実行できない
4. 監督審査及び改革
「審査通則」に基づき、「現場調査通過」と判定される申請企業は、1ヶ月以内に現場調査過程中に発見される問題を改革し、申請企業日常の食品安全監督管理機構にその改革結果を書面報告しなければなりません。また、申請企業日常の食品安全監督管理機構は、3ヶ月以内に「現場調査通過」と判定される申請企業に対して監督審査を行い、現場調査過程中に発見される問題がよく改革されたかどうかを重点的に審査します。
結論
域外の申請企業に対し、
1)製品処方登録の現場調査の時間は実際状況に基づいて確定します
2)製品製造許可の現場調査は不要で、域外申請企業がFSMP製造企業とする資格がある証明書のコピー件を提出します
製品処方登録の現場調査も製品製造許可の現場調査も、申請資料に基づいて技術審査評価のことです。現場調査の主要目的は、申請企業の実際状況が申請資料と一致するかどうか、真実であるかどうか、製造する製品に適合するかどうか、関連した法規制の要求に合致するかどうかを審査することです。特殊医学用途調整食品の現場調査に関する法規制を確認したい方は、こちらをクリックしてご確認ください。
お問い合わせ
service@cirs-group.com



