2020年12月1日、中国国家市場監督管理総局(SAMR)は「コエンザイムQ10等5種の保健食品原料目録」(以下は「原料目録」と略称する)を公表しました。従いまして、コエンザイムQ10、壊れた壁霊芝胞子粉末、スピルリナ、魚油、メラトニンを単一原料とする保健食品は:
1) 2020年12月1日以後、国産製品は保健食品届出を申請し、輸入製品は保健食品登録を申請します。
2) 2020年12月1日以前に既に受理された国産、輸入製品の登録申請、及び既に登録許認可を取得した相関保健食品は、「登録から届出へ変更」を申請します。
「登録から届出へ変更」とは
製品は既に登録許認可を取得した、或は製品の登録申請は既に受理された場合の届出申請方式です。
新規製品として直接に届出を申請することではなくて、「登録から届出へ変更」を申請する原因は何ですか
国産保健食品:「登録から届出へ変更」は唯一の選択ではないが、利好政策がある
コエンザイムQ10等5種の原料を単一原料とする国産保健食品は、新規製品として直接に届出を申請することができ、「登録から届出へ変更」の方式で届出を申請することもできます。
「登録から届出へ変更」のメリットは、一部の製品は効能成分/特性成分、衛生学、安定性試験を再び進行する必要がない(このメリットは「登録から届出へ変更」方式を利用する輸入保健食品にも適用できる)ので、申請周期を大幅に短縮することができます。
- 既に登録許認可を取得した保健食品の「登録から届出へ変更」は、原料、補助原料、配合量、技術要求が変わらない場合、製品の試験報告は全項目検査報告だけを提出すればよくて、製品の効能成分/特性成分、衛生学、安定性試験の報告を提出する必要がありません。
- 「原料目録」が公表された前に既に登録申請として受理された保健食品の「登録から届出へ変更」は、原料、補助原料、配合量、技術要求が変わらない場合、製品の効能成分/特性成分、衛生学、安定性試験の報告は登録申請した際に提出された試験報告を直接に使用することができます。その同時に全項目検査報告を共に提出すればよいです。
輸入保健食品:「登録から届出へ変更」は唯一の選択
- コエンザイムQ10等5種の原料を単一原料とする保健食品の届出申請は国産保健食品だけに適用し、初回輸入の保健食品に適用できません。つまり、コエンザイムQ10等5種の原料を単一原料とする初回輸入の保健食品は、届出申請できなくて、登録申請しなければなりません。
- 既に登録許認可を取得した相関製品は、登録許認可の期限延長を申請できません。登録許認可の有効期限が切れる前に「登録から届出へ変更」を申請すべきです。
- 「原料目録」が公表された前に既に登録申請として受理された輸入保健食品は、「原料目録」内の原料を使用するなら、「登録から届出へ変更」を申請すべきです。
「登録から届出へ変更」は二つのステップを含む
1) 申請者が合格的な登録申請企業であることをSAMRに確認し、資格証明を取得する
2) 製品の届出を申請する
具体的には、以下の通りです。
1) 申請者が合格的な登録申請企業であることをSAMRに確認し、資格証明を取得する(以下は「登録申請企業資格確認証明」と略称する)
「登録から届出へ変更」を申請する前に、申請企業は登録申請企業資格確認証明を取得しなければなりません。以下は登録申請企業資格確認証明を申請可能な状況です。
- 既に受理された保健食品:「原料目録」が公表された前に、既に登録申請として受理されたこの5種の原料を単一原料とする保健食品、しかも、製品も保健食品届出申請の相関技術要求に合致する場合、登録申請企業資格確認証明を申請することができます。
- 既に登録許認可を取得した保健食品:この5種の原料を単一原料とする保健食品、しかも、製品も保健食品届出申請の相関技術要求に合致する場合、登録申請企業資格確認証明を申請することができます。
- 「原料目録」が公表された前に、既に登録申請として受理された保健食品、或は既に登録許認可を取得した保健食品なら、製品の部分原料或は配合量が「原料目録」及び保健食品届出申請の相関技術要求に合致しない場合、登録申請企業或は許認可所有者が「原料目録」に従って製品原料及び製品技術要求を調整することを同意したら、登録申請企業資格確認証明を申請することができます。
登録申請企業資格確認証明の申請流れ
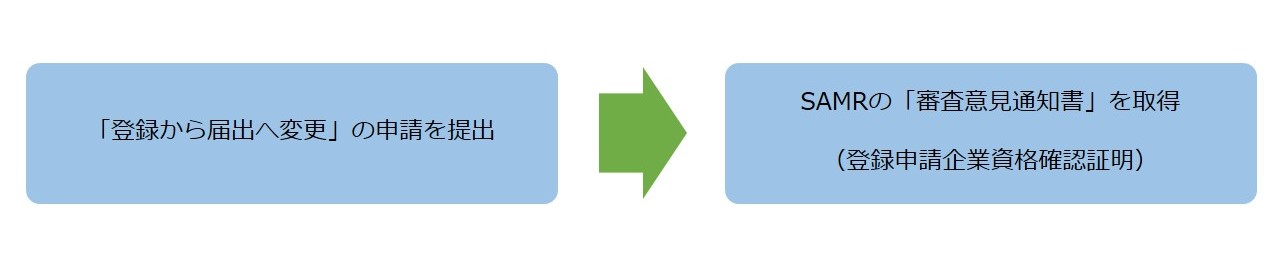
● 既に登録許認可を取得した保健食品は、以下のルートで登録申請企業資格確認証明を取得することができます。
流れの具体的な説明
① 登録申請企業が保健食品登録管理システムに、「登録から届出へ変更」の申請を提出します。
② SAMRの「審査意見通知書」を取得します。この「審査意見通知書」は、登録申請企業資格確認証明とのことです。
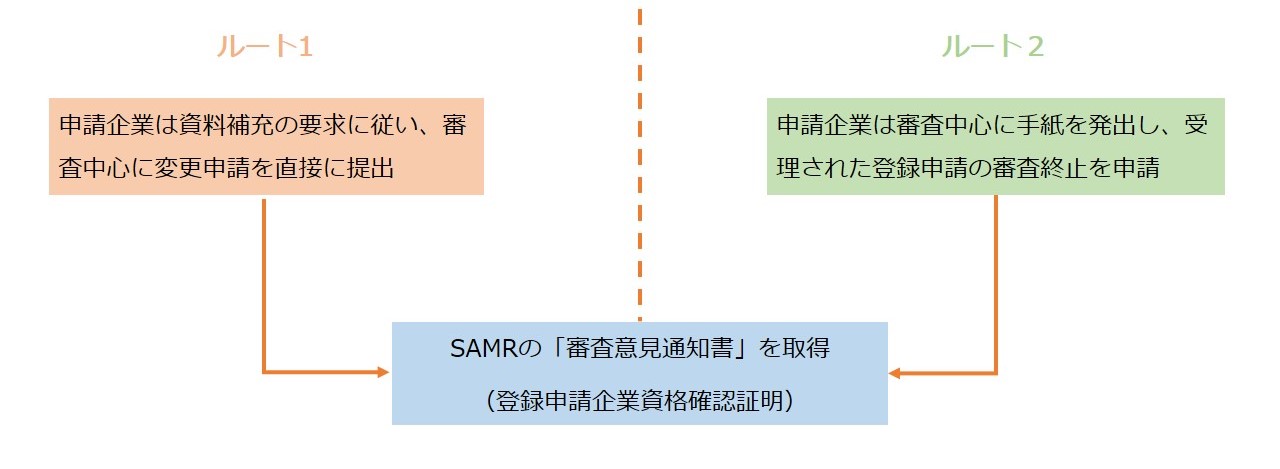
● 「原料目録」が公表された前に既に受理された新規製品の登録申請、登録有効期限延長、登録変更、技術譲渡は、以下二つのルートで登録申請企業資格確認証明を取得することができます。
流れの具体的な説明
① 申請企業は、ルート1或はルート2を選択して登録申請企業資格確認証明を取得することができます。具体的は以下の通りです。
ルート1:申請企業は資料補充の要求に従い、審査中心に変更申請を直接に提出します。
ルート2:申請企業は審査中心に手紙を発出し、受理された製品登録申請の審査終止を申請します。
② SAMRの「審査意見通知書」を取得します。この「審査意見通知書」は、登録申請企業資格確認証明とのことです。
注:ルート1中の「資料補充」について、一般的には、申請企業は審査中心から「資料補充」の要求を受けた後に要求に従って補充資料を提出するという流れです。この「資料補充」の際に「登録から届出へ変更」の申請を提出することができます。保健食品届出要求に合致する製品に対し、一般的に、審査中心は「資料補充」を要求しなくて、「未認可通知書」を直接に発出します。この「未認可通知書」も、登録申請企業資格確認証明とのことです。ただし、ルート1を選択する場合、審査中心の「未認可通知書」を待つのが必要なので、申請企業にとっては少し受動的かもしれません。
登録申請企業資格確認証明を申請する際の資料要求(既に登録許認可を取得した保健食品)
国産保健食品
① 国産保健食品登録変更申請書、資料真実性の法律責任承諾書
② 登録申請者主体登記証明資料のコピー件
③ 保健食品登録許認可のコピー件
④ 変更の具体的な事項、理由及び根拠
⑤ 「登録から届出へ変更」の申請書
輸入保健食品
① 国産保健食品登録変更申請書、資料真実性の法律責任承諾書
② 登録申請者主体登記証明資料のコピー件
③ 保健食品登録許認可のコピー件
④ 製品製造国(地域)の政府主管機構又は法律サービス機構によって発行した申請者が保健食品の域外製造者であることを証明する資格証明書
⑤ 製品製造国(地域)の政府主管機構又は法律サービス機構によって発行した保健食品が1年以上の販売実績があることを証明する証明書、或は製品の域外販売状況及び対象者食用状況の安全性報告
⑥ 製品製造国(地域)が製品に対して認可制度で管理する場合、製品製造国(地域)の政府主管機構が保健食品の市場販売を認可する証明資料を提出すべき
⑦ 製品製造国(地域)又は国際組織が公布した保健食品製品に関する技術法規或は関連標準
⑧ 変更後の製品包装、ラベル、説明書の現物
⑨ 域外申請者の中国代表機構によって申請する場合、「外国企業常駐中国代表機構登記証」のコピー件を提出する;域外申請者が域内の代理機構を委託して登録を申請する場合、公証された委託書の原本及び委託された代理機構の営業許可書のコピー件を提出する
⑩ 変更の具体的な事項、理由及び根拠
⑪ 「登録から届出へ変更」の申請書
2) 製品の届出を申請する
● 国産保健食品:登録申請企業の身分として、届出管理部門に届出管理システムアカウントを申請(システムアカウントを持っている企業は除外)し、製品の届出を申請します。
● 輸入保健食品:製品の届出申請に関する政策はまだ不明です。
中国国家市場監督管理総局が2017年7月5日に公表された「製品の登録から届出への変更の流れ」に関する解答に基づき、企業は登録申請企業資格確認証明である「審査意見通知書」を取得した後、登録申請企業の身分として届出管理システムアカウントの申請(システムアカウントを持っている企業は除外)と製品届出の申請を提出すべきです。ただし、輸入保健食品届出システムから見ると、中に「機能性保健食品」の申請ルートがありません。CIRSがSAMR審査中心先生と確認した結果によりますと、現時点、輸入保健食品(コエンザイムQ10等5種の原料を単一原料とする輸入保健食品)の申請企業が登録申請企業資格確認証明を取得した後、その製品の届出申請は如何に進行すべきかに対し、政府部門はまだ検討中となります。
CIRSはコエンザイムQ10等5種の原料を単一原料とする輸入保健食品の「登録から届出へ変更」に関する政策変動をフォローしていきます。既に登録許認可を取得した輸入製品に対し、登録申請企業資格確認証明を取得するために数多くの証明書類が必要となり、これらの証明書類を準備するために申請企業はかなりの時間がかかるかもしれません。従いまして、輸入保健食品の「登録から届出へ変更」に関する政策が確定した後に企業が速やかに市場進入できることを目的として、相関企業は登録申請企業資格確認証明の取得に必要な証明書類を事前に準備すべきだと考えております。
お問い合わせ



