中国現行法規制に基づき、登録類保健食品(機能性保健食品)が表示可能保健機能は「保健食品機能目録」に収載しなければなりません。現時点、「保健食品機能目録」に収載する保健食品機能は総計24種があり、つまり、申請企業はその中から製品に適合的な保健機能を選択しなければなりません。
また、保健機能目録の管理を規範化させる為に、中国国家市場監督管理総局(SAMR、元CFDA)は「保健食品原料目録及び保健機能目録管理弁法」と「保健食品新機能及び製品技術評価実施細則(試行)」(以下は、「実施細則」と略称)を公布し、保健機能の創新を推し進めます。つまり、保健食品新機能の申請は可能になります。
保健食品新機能の法規制現状
法規制 | 施行期日 |
保健食品原料目録及び保健機能目録管理弁法 | 2019年10月1日から施行 |
保健食品新機能及び製品技術評価実施細則(試行) | 2023年8月28日から施行 |
保健食品新機能申請者の資格要求
- 保健食品新機能の申請者はいかなる企業または個人となる。
- いかなる企業または個人は、相関研究を行った後に、中国国家市場監督管理総局食品審査評価センター(以下は、「食品審査評価センター」と略称)に保健食品新機能を単独的、連合的に申請できる。
保健食品新機能の定位
保健食品新機能の定位は明確的でなければならなくて、以下3種類に分けられる。
- 膳食栄養物質の補充
- 体健康状況の維持/改善
- 疾病発生リスクの減少
保健食品新機能申請の流れ
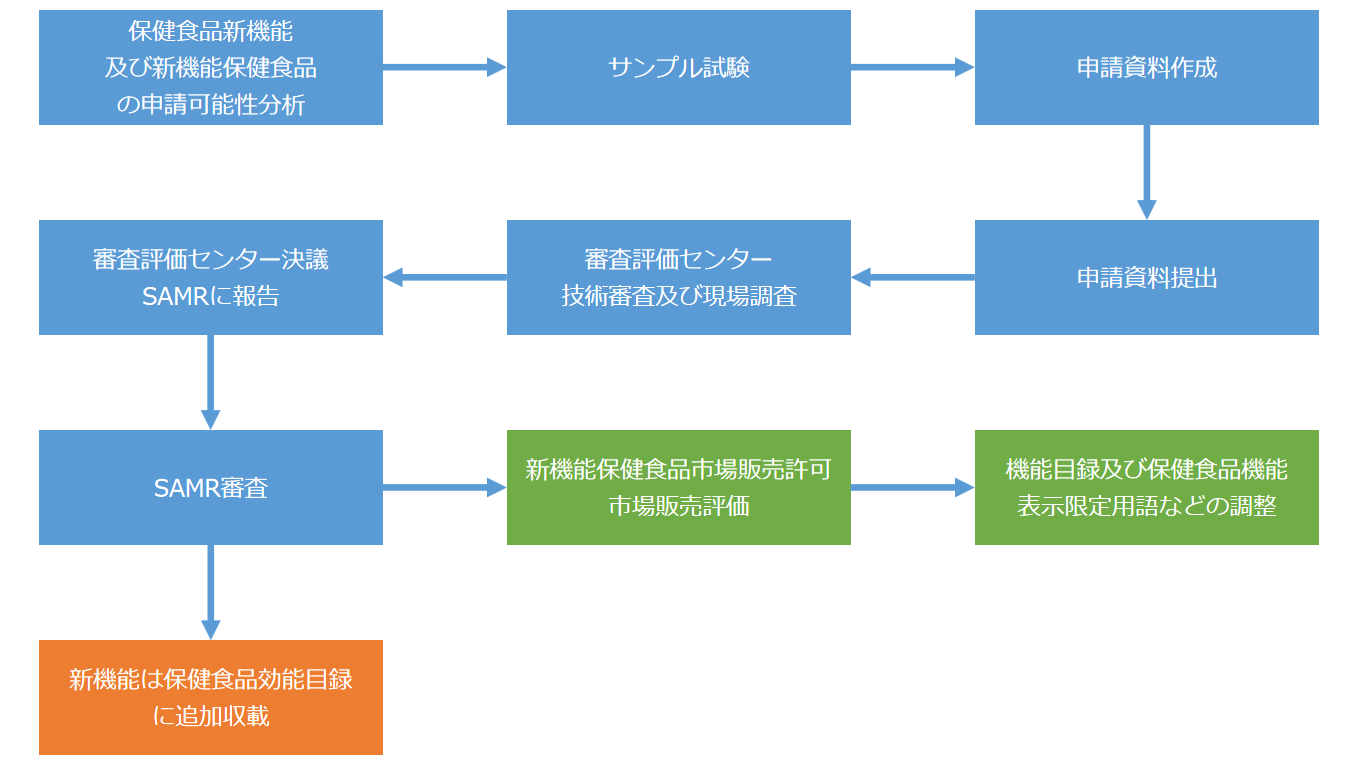
注:申請者は保健食品新機能(機能)申請及び新機能保健食品(製品)申請を同時に提出できる。審査評価センターは同時に受理し、審査を行う。
申請資料の要求
1. 保健食品新機能申請の資料要求
保健食品新機能を申請する際に、申請者は「実施細則」付録の「保健食品新機能提案資料項目要求と技術評価要点」に従って技術評価資料を提供する。具体的には、
- 新機能申請の資料目録
- 資料真実性に責任負いの申請者承諾書
- 申請者身分証明または主体登記証明のスキャンファイル
- 保健機能の名称、解釈、機理およびその根拠
- 保健機能研究報告
- 保健機能の評価方法および検証評価資料
- 同じまたは類似の保健機能が国内外にての応用状況
- 技術評価に役立つ科学文献根拠および他の相関資料
- 保健機能倫理学相関資料
- 新機能サンプルの技術評価相関資料
- 新機能申請と評価に関する他の資料
- ヒト食用試験評価に関する他の資料
- 説明する必要な他の問題
2. 新機能能保健食品申請の資料要求
新機能保健食品を申請する際に、申請者は保健食品登録管理の相関規定に従って申請資料を提供し、しかも、申請者の資格も相関要求に合致しなければならない。



