2023年8月31日、中国国家市場監督管理総局(SAMR)は「保健食品表示可能な保健機能目録 非栄養素補充剤類(2023年版)」及びそのシリーズ規制を公布し、既に保健機能目録に収載しながら、機能表示用語は旧版保健機能(例えば、免疫調節など)である許認可について、企業は新旧保健機能転換と最新版評価要求に従って「引き換え」手続きを完成しなければならないことを要求します。
上述規制に基づき、旧版時代の保健食品許認可の「引き換え」はついに開始します。つまり、旧版時代の保健食品許認可(特に衛生部時代の許認可)は規定時限以内に、要求に従って効能学試験を再び進行/追加進行し、「登録変更」の方式で新たな許認可を取得する必要です。これらの旧版時代許認可について、中国当局は5年の猶予時間を設定します。つまり、旧版時代の保健食品許認可の所有企業は、5年以内に保健機能表示の転換を完成しなければなりません。
効能学試験を再び進行/追加進行し、「登録変更」を申請する必要な「旧版時代許認可」とは
以下2つの条件に同時満足する登録認可した製品は、要求に従って効能学試験を再び進行/追加進行した後に、「登録変更」を申請しなければなりません。要求に合致できれば、中国SAMRは申請企業に新たな許認可を与えます。
1. 当時の効能学評価根拠が「保健食品効能学評価プロセスと検験方法(1996年版)」となる
2. その同時、製品の保健機能は「表1」にての8類の保健機能となる
表1 効能学試験を再び進行/追加進行する必要な8類の旧版時代許認可
NO. | 旧保健機能 | 新保健機能 | 当時の効能学試験根拠が「1996年版評価方法」であれば、再び進行/追加進行する必要な効能学試験項目 |
1 | 免疫調節、免疫力増強 | 免疫力増強を助ける | 動物試験を再び進行 |
2 | 老衰遅らし、抗酸化 | 抗酸化を助ける | ヒト食用試験を追加進行 |
3 | 記憶力改善、記憶力改善の補助 | 記憶力改善を助ける | ヒト食用試験はウェクスラー記憶検査法を使用する場合、ヒト食用試験を再び進行 |
4 | 抗疲労、体疲労の緩和 | 体疲労の緩和 | 行動試験はポールテストを使用する場合、動物試験を再び進行 |
5 | 耐酸素不足、酸素不足耐性増強 | 耐酸素不足 | 動物試験を再び進行 |
6 | ダイエット | 体内脂肪調節を助ける | 効能学試験を再び進行 |
7 | 血脂調節(総コレステロール低下、トリアシルグリセロール低下)、血脂低下 | 血脂(コレステロール/トリアシルグリセロール)健康水平の維持を助ける | ヒト食用試験を再び進行 |
8 | 抗放射線、放射線危害の補助保護 | 電離放射線危害の補助保護 | 動物試験を再び進行 |
登録変更の資料要求
1. 国産保健食品の登録変更
- 保健食品登録変更申請書、及び資料真実性に責任負いの申請者法律責任承諾書
- 申請者主体登記証明資料のコピーファイル
- 登録許認可及びその付録のコピー件
- 変更前後の具体事項、変更の理由及び根拠
- 変更事項に関する具体的な資料
2. 輸入保健食品の登録変更
国産製品の要求に従って相関資料を提出する以外、以下資料を追加提出:
- 製品製造国(地域)の政府主管部門又は法律サービス機構によって発行した証明書、申請者が保健食品の海外製造者であることを証明する
- 製品製造国(地域)の政府主管部門又は法律サービス機構によって発行した証明書、保健食品が1年以上の販売実績あることを証明する
- 製品製造国(地域)が製品に対して認可制度を実施する場合、製造国(地域)主管部門が製品販売を認可する証明書を提供する
- 製品製造国(地域)又は国際組織が公布した保健食品に関わる法規制または標準の原文
- 変更後の製品包装、ラベル、説明書の現物
- 海外申請者の常駐中国代表機構によって登録を申請する場合、「外国企業常駐中国代表機構登記証」のコピー件を提出する。海外申請者が中国国内の代理機構を委託して登録を申請する場合、公証済み委託書の原本及び受託代理機構の営業許可書のコピー件を提出する
- 製品製造国(地域)の政府主管部門又は法律サービス機構によって発行した証明書、申請事項が既に変更したことを証明する
旧版時代許認可の「引き換え」を申請する際の注意事項
1. 登録変更を申請する際に、申請者は現行法規制の要求に従ってラベル説明書の原稿、製品技術要求などの内容を更新する
2. 製品名称は「保健食品命名指南(2019年版)」などの相関規定に合致する必要。もし、名称が要求に合致しない場合、名称変更を申請する
3. 保健機能評価試験に関わる場合、法定資格に合致する試験機構より発行した試験用サンプルの衛生学試験報告も同時に提供する必要。ヒト食用試験に関わる場合、倫理審査認可およびヒト食用評価資料も同時に提供する必要
4. 必要であれば、申請者は幾つの事項の登録変更を同時に申請できる
旧版時代許認可「引き換え」の流れ
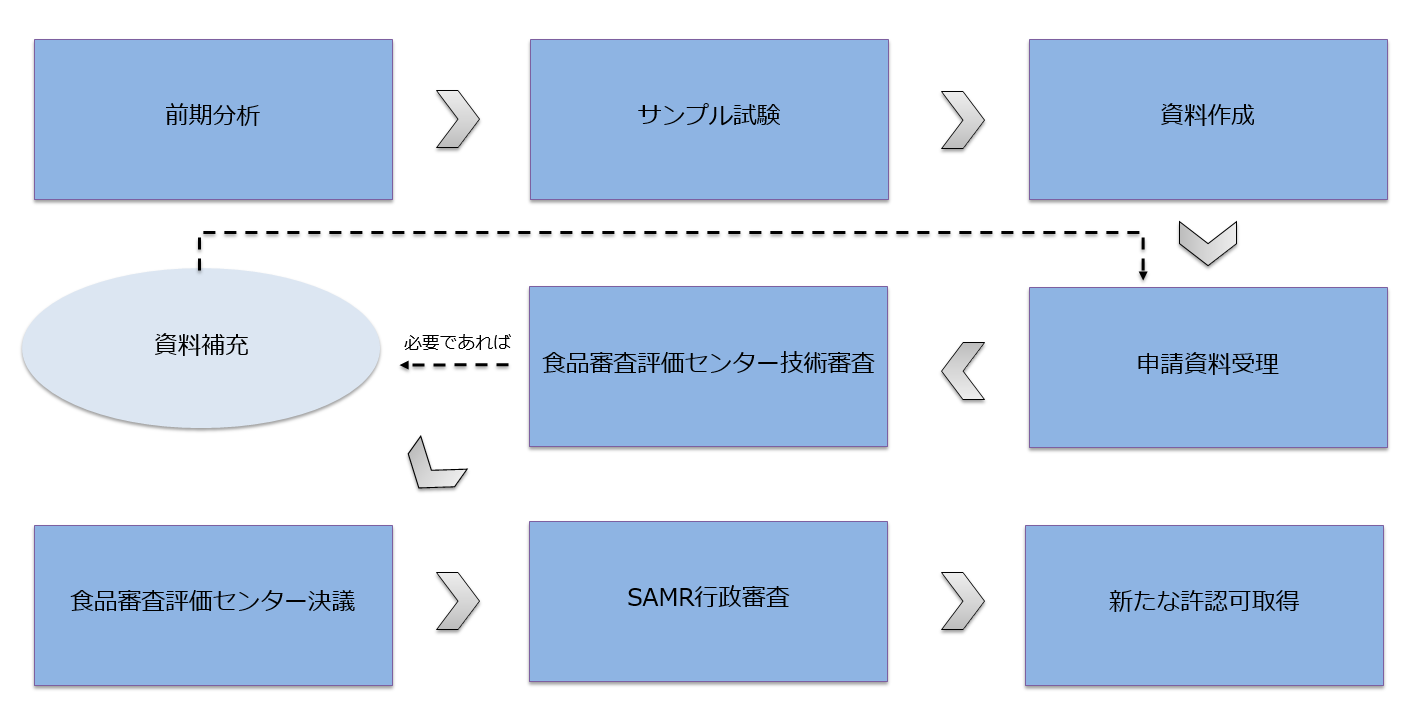
旧版時代許認可「引き換え」の推定周期
最初の「サンプル試験」と「資料作成」から、最後の「新たな許認可取得」まで、一般的に、所要周期は1-2年と推定します。



