現行「中華人民共和国食品安全法」は、保健食品に対して厳格的な監督管理を行います。保健食品の管理を規範化、統一化させるために、中国国家市場監督管理総局(SAMR、元CFDA)は「保健食品登録及び届出管理弁法」、「保健食品登録申請服務指南」、「保健食品登録審査細則」などの法規制を制定し、保健食品の登録変更を申請する際の資料要求などを明確します。
「保健食品の登録変更」とは
保健食品の登録変更は、食品薬品監督管理部門が申請企業の申請に応じて、法定手続き、条件、要求などに基づき、保健食品許認可変更の申請を審査、認可することです。
申請企業の要求
(1) 保健食品許認可及びその付録の内容変更を申請する場合、許認可の所有企業によって申請を提出し、変更理由及び根拠などを説明しなければなりません。
(2) 企業名称の変更を申請する場合、名称変更後の企業によって申請を提出しなければなりません。
保健食品登録変更を申請する際の資料要求
1. 国産保健食品
(1) 申請書及び法律責任承諾書
(2) 登録申請者主体登記証明資料のコピー件
(3) 保健食品許認可及びその付録のコピー件
(4) 変更前と変更後の具体事項、変更の理由及び根拠
2. 輸入保健食品
国産製品の要求に従って上述した相関資料を提出する以外、以下資料を追加提出します。
(1) 製品製造国(地域)の政府主管機構又は法律サービス機構によって発行した証明書、申請者が保健食品の域外製造者であることを証明する
(2) 製品製造国(地域)の政府主管機構又は法律サービス機構によって発行した証明書、保健食品が1年以上の販売実績があることを証明する
(3) 製品製造国(地域)が製品に対して認可制度を施行する場合、製造国(地域)主管部門が製品販売を認可する証明書を提供する
(4) 製品製造国(地域)又は国際組織が公布した保健食品に関わる法規制(或は)標準原文
(5) 変更後の製品包装、ラベル、説明書の現物
(6) 域外申請者の中国国内拠点によって登録を申請する場合、「外国企業常駐中国代表機構登記証」のコピー件を提出する。域外申請者が中国国内の代理機構を委託して登録を申請する場合、公証された委託書の原本及び委託された代理機構の営業許可書のコピー件を提出する
(7) 製品製造国(地域)の政府主管機構又は法律サービス機構によって発行した証明書、申請事項が既に変更されたことを証明する
3. 具体的な変更事項に基づき、以下資料を追加提出
NO. | 変更事項 | 変更する際の資料要求 | |
国産保健食品 | 輸入保健食品 | ||
1 | 企業自身の名称、所在 | 地方工商行政管理部門が発行した証明書、企業の名称、所在は既に変更したことを証明する | 製品製造国(地域)の政府主管機構又は法律サービス機構によって発行した証明書、保健食品の製造場所は変更していないことを証明する |
2 | 製品名称 | ● 変更後の製品通用名称は既に登録認可された薬品の名称と不同名の検索資料 ● 変更後の製品通用名称は既に登録認可された保健食品の名称と不同名の検索資料 ● 原料或は原料略称以外の製品特性を表明する文字を通用名として使用する場合、命名説明も共に提出すべき | |
3 | 保健機能増加 | ● 増加する保健機能の論証報告 ● 増加する保健機能の試験評価資料。対象者の実際食用試験に関わる保健機能なら、倫理審査認可書及び対象者食用評価資料も共に提出すべき ● 増加する保健機能の試験に用いられるサンプルの衛生学試験報告 ● 修正後のラベル説明書の設計原稿 | |
4 | 製品規格、保存方式、賞味期限、補助原料、製造工程及び製品技術要求など | ● 3ロットサンプルの効能成分/特性成分試験、衛生学試験、安定性試験の報告(製品技術要求の引用標準が既に更新、代替されたが、標準内容は実質的な変更がない場合、上述した試験報告を提供しなくてもいい) ● 製品処方、ラベル説明書設計原稿、製品技術要求、製造工程資料の変更に関わる場合、修正後の相関資料を提出すべき ● 製造工程を変更する場合、文献根拠、試験データを提出すべきで、変更前後の製造工程に対して対比分析を行い、工程変更後の製品の安全性、保健機能、品質制御は元の製品と実質同等であることを証明する | |
5 | 適用対象者、適用除外者、注意事項、摂取方法、摂取量 | ● 修正後のラベル説明書設計原稿 ● 適用対象者、適用除外者、摂取方法、注意事項を変更する場合、以下資料を追加提出すべき ① 製品安全性、保健機能に影響しない根拠 ② 元の登録を申請する際に提出した安定性試験、保健効能評価試験、衛生学試験、安定性試験の報告は、変更後の適用対象者、適用除外者、摂取方法、注意事項に十分的適用できない場合、安定性試験、保健効能評価試験、衛生学試験、安定性試験を再び進行すべき ● 摂取量減少を変更する場合は、変更後摂取量での保健効能評価試験報告を追加提出すべき ● 摂取量増加を変更する場合は、以下資料を追加提出すべき ① 変更後摂取量での毒性学試験報告 ② 変更後の摂取量と元の摂取量に比べる保健効能評価試験報告 | |
● 以下の変更事項は国産保健食品だけに適用
NO. | 変更事項 | 資料要求 |
1 | 申請企業はその他の企業と吸収合弁、或は新設合弁 | ● 申請企業合弁前後の営業許可書のコピー件 ● 地方工商行政管理部門が発行した証明書、企業が合弁/取り消ししたことを証明する ● 申請企業と関連企業が製品許認可所有権に対して異議無しの声明及びその公証資料 |
2 | 申請企業が分立して完成子会社を設立 | ● 申請企業及びその完全子会社の営業許可書のコピー件 ● 地方工商行政管理部門が発行した証明書、申請企業が完成子会社を設立したことを証明する ● 資本検験機構が発行した証明書、保健食品に関わる全ての製造現場、設備施設、製造人員、製品許認可などを完全子会社に与えた後の資本検験機構 ● 申請企業が保健食品に関わる全ての製造現場、設備施設、製造人員、製品許認可などを完全子会社に与えることを同意する決議及び認可書 ● 与える前後、製造現場、設備施設、製造工程、品質標準、製造人員などの製品品質安全と関わる条件、要求が発生しない承諾書 |
● 以下の変更事項は輸入保健食品だけに適用
NO. | 変更事項 | 資料要求 |
1 | 域外製造工場(製造国/地域を変更しない) | ● 新しい製造工場の製造国(地域)、政府主管機構又は法律サービス機構が発行した証明書、保健食品が製造国(地域)にての製造/販売を許容することを証明する ● 保健食品が新しい製造工場の製造国(地域)に市場販売する際の包装、ラベル、説明書の実物、変更後のラベル説明書設計原稿 ● 新しい製造工場に製造される3ロットのサンプルの効能成分/特性成分試験、衛生学試験、安定性試験の報告 ● サンプル製造国(地域)政府主管機構又は政府主管機構が指定する法律サービス機構が発行した証明書、新しい製造工場が良好製造品質管理規範に合致することを証明する ● 域外製造企業が発行した承諾書、製造する中国向けの保健食品が中国相関法律、行政法規、食品安全国家標準の要求に合致することを保証する ● その他の必要な資料 |
2 | 域外製造工場(製造国/地域を同時に変更) | ● 許認可所有企業が発行した申請書、元の許認可を取り消すことを申請する ● 製品処方資料 ● 製品製造工程資料 ● 3ロットのサンプルの効能成分/特性成分試験、衛生学試験、安定性試験の報告 ● 保健食品と直接に接触する包装資材の種類、名称、関連標準等 ● 製品ラベル、説明書の設計原稿。製品の通用名称が既に登録認可された薬品の名称と不同名の検索資料、製品の通用名称が既に登録認可された保健食品の名称と不同名の検索資料 ● 製品技術要求 ● 販売最小単位のサンプル3点 ● その他の必要な資料 |
保健食品登録変更を申請する際の注意事項
(1) 製品原料が保健食品原料目録に収載され、しかも、相関技術要求に合致する場合、保健食品の「登録から届出へ変更」を申請しなければなりません。
(2) 変更事項は許認可及びその付録の内容に限定され、しかも、製品品質の実質変更を起こしてはいけません。
(3) 製品処方原料及びその配合量を変更してはいけません。ただし、現行法規、国家標準などの変更に基づいて許認可及びその付録の内容が既に要求に合致しない場合は変更可能です。
(4)同一製品に対して多種の変更事項を同時に申請することができます。製品が審査中の変更事項があるなら、申請企業はこの変更事項及び受理番号の書面説明を提出すべきです。審査中の変更事項が2016年12月31日以前に既に受理された場合、申請企業は申請が完了した後にその他の変更事項を申請すべきです。
(5) 審査する過程中、申請企業の名称、所在地が変更する場合、申請企業は補充資料を提出することができます。
保健食品の登録変更に関わる法規制
● 「中華人民共和国食品安全法」及びその実施条例
● 「保健食品登録及び届出管理弁法」
● 「保健食品登録申請服務指南」
● 「保健食品登録審査細則」
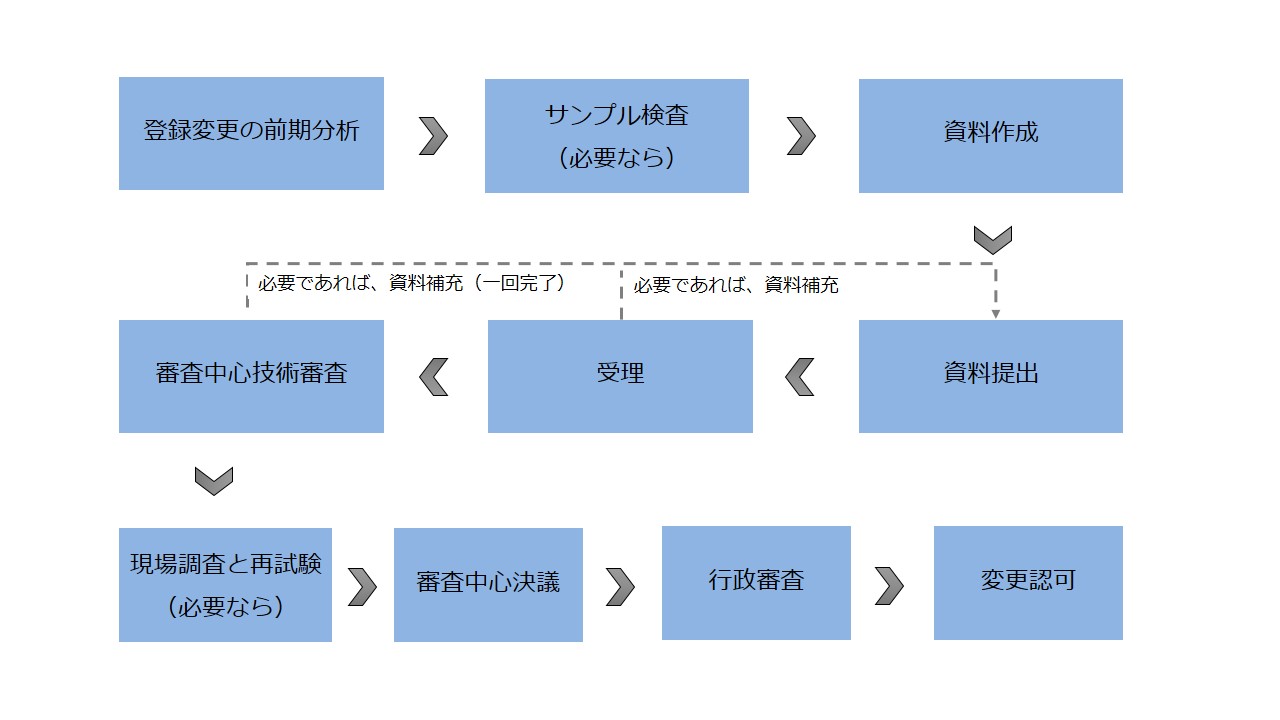
保健食品登録変更の流れ
CIRSのザービス
CIRSはお客様に中国食品の法規制対応サービスを提供いたします。保健食品に対し、以下サービスを提供いたします。
● 保健食品の期限延長(再登録)
● 保健食品登録の代行
● 保健食品届出の代行
● 保健食品の技術譲渡
● 保健食品の法規トレーニング
● 保健食品の法規動向モニタリング
● 単項目技術サービス
√ 製品分類及び処方の実行性分析
√ 中国語ラベル及び包装説明書の設計
√ 書類準備
√ 翻訳
√ 試験手配及び進捗フォローアップ



