中国の健康食品とは
中国の健康食品(中国では、「保健⾷品」と呼ぶ)とは、特定保健機能有り、又はビタミン・ミネラル補充などの栄養物質を目的する食品であり、特定対象者向けの食用に適して、体調整の機能を有します。疾病治療が目的ではなく、人体に急性、亜急性又は慢性的に危害を与えない食品を指します。
健康食品の類別
中国の健康食品は、以下二種類に分けられます。
I. 栄養素補助剤
ビタミン・ミネラルをなどの栄養物質補充し、エネルギー或いは他の活性成分を提供しません。
II. 機能性健康食品
特定保健機能があり、人体の生理反応が起こります。
法規背景
「中華人民共和国食品安全法」によりますと、健康食品を中国市場に販売・輸出しようとする企業は、健康食品の登録許認可または届出許認可を申請して取得しなければなりません。中国国産健康食品なら、登録申請は国家市場監督管理総局(SAMR、元CFDA)に提出し、届出申請は省レベルの市場監督管理局に提出します。中国海外製造の輸入健康食品なら、登録申請も届出申請も国家市場監督管理総局(SAMR、元CFDA)に提出します。その同時、外国企業は中国国内拠点或は中国国内の代理機構に登録申請や届出申請の事項を委託しなければなりません。
中国健康食品の法規制
通用法規制
法規制 | 公表期日 | 施行期日 |
中華人民共和国食品安全法(2021年訂正版) | 2015.04.24 | 2015.10.01 |
2016.03.01 | 2016.07.01 | |
2014.12.24 | 2015.05.24 | |
2019.08.20 | 2020.01.01 | |
2019.11.12 | 2019.11.12 |
届出類保健食品法規制
法規制 | 公表期日 | 施行期日 |
2017.05.02 | 2017.05.02 | |
2023.06.14 | 2023.10.01 | |
2023.06.14 | 2023.10.01 | |
2023.06.14 | 2023.10.01 | |
2023.06.14 | 2023.10.01 | |
2023.09.29 | 2023.10.01 | |
2020.12.01 | 2021.03.01 | |
2021.02.20 | 2021.06.01 | |
2021.02.20 | 2021.06.01 |
登録類保健食品法規制
法規制 | 公表期日 | 施行期日 |
2016.11.17 | 2016.11.17 | |
2016.12.19 | 2016.12.19 | |
2020.10.31 | 2020.10.31 | |
2020.10.31 | 2020.10.31 | |
2020.10.31 | 2020.10.31 | |
2023.08.31 | 2023.08.31 | |
2023.08.31 | 2023.08.31 | |
2023.08.31 | 2023.08.31 | |
2023.08.31 | 2023.08.31 |
中国健康食品の登録及び届出は「保健食品登録及び届出管理弁法」に基づいて申請しなければなりません。詳細は以下の通りです。
I. 健康食品の届出
届出申請可能な製品
- 栄養素補助剤(国産製品も輸入製品も適用):ビタミン・ミネラルなどの栄養物質を補充し、しかも、原料は「保健食品原料目録 栄養素補助剤」の要求に合致し、補助原料は「保健食品届出製品に使用可能な補助原料及びその使用規定」の要求に合致する栄養素補助剤
- 機能性健康食品(国産製品のみ適用):コエンザイムQ10、壊れた壁霊芝胞子粉末、スピルリナ、魚油、メラトニンを単一原料とする健康食品、或は大豆分離蛋白、乳清蛋白を原料とする健康食品。しかも、相応する「保健食品原料目録」の要求に合致する機能性健康食品
届出申請者の資格
- 国産健康食品届出申請者は中国国内の保健食品製造企業となります。つまり、国産健康食品届出申請者は製品の製造を委託してはいけません。
- 輸入健康食品届出申請者は国外製造企業(法人格及びその他の組織を指す)となります。つまり、輸入健康食品届出申請者は製品の製造委託できます。
健康食品届出の流れ
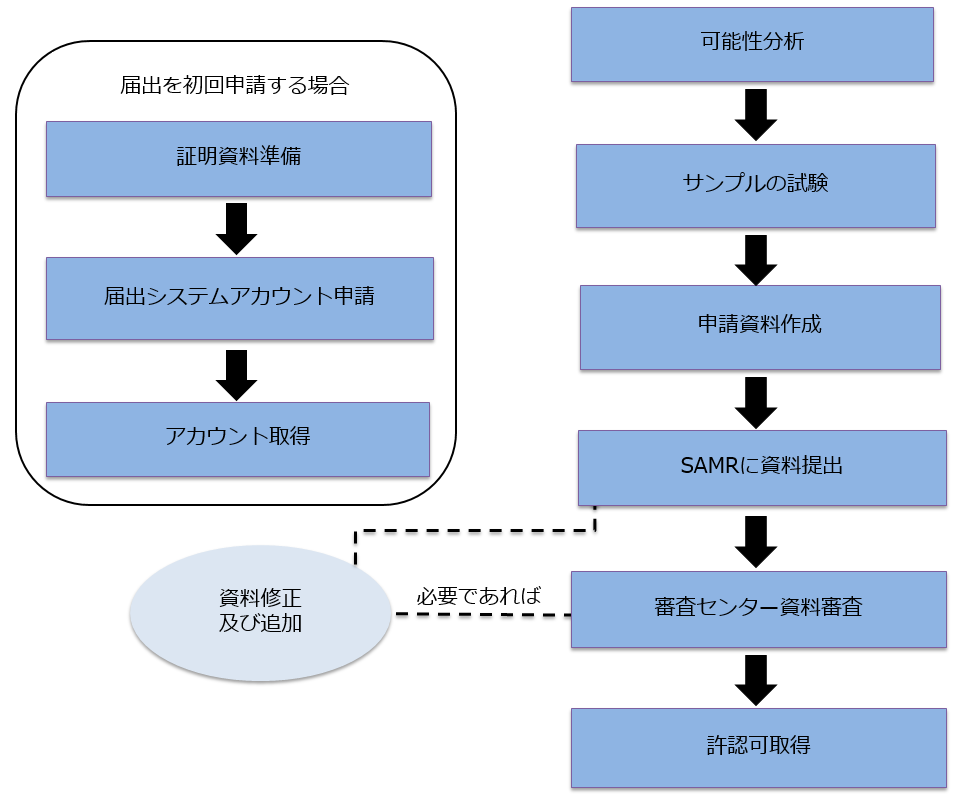
健康食品届出の申請資料
- 届出申請書及び法律責任承諾書
- 届出申請者主体の登記証明資料
- 製品処方資料
- 製品製造工程資料
- 製品安全性及び保健効能評価資料(安定性試験報告、原料補助原料合理使用の説明等)
- 保健食品と直接に接触する包装材の種類、名称、関連標準等
- 製品ラベル、説明書の見本
- 製品技術要求資料
- 製品技術要求に合致する全項目検査報告書
- 製品名称の相関検索資料
- 製品安全性及び保健効能を表明できるほかの資料
また、輸入健康食品の届出申請は、以下資料を追加しなければなりません。
- 製品製造国(地域)、政府主管機構又は法律サービス機構によって発行した証明書、申請者が保健食品の域外製造者であることを証明する。
- 製品製造国(地域)、政府主管機構又は法律サービス機構によって発行した証明書、類似した保健食品が1年以上の販売実績があることを証明する。
- 製品製造国(地域)又は国際組織が公布した保健食品製品の技術法規或は関連標準、製造品質管理体系の有効実行を証明できる自己検査報告、良好製造品質管理規範に合致する証明資料。
- 製品製造国(地域)に販売する製品の包装、ラベル、説明書の現物。
- 域外申請者の中国代表機構によって届出を申請する場合、「外国企業常駐中国代表機構登記証」のスキャンを提出する;域外申請者が中国域内の代理機構を委託して届出を申請する場合、公証された委託書の原本及び委託された代理機構の営業許可書のスキャンを提出する。
健康食品届出の試験要求
栄養素補助剤の場合、必要な試験は以下の通りです。
- 3ロット製品の効能成分或は特性成分、衛生学検査、安定性試験
- 3ロット製品の製品技術要求に合致する全項目検査
機能性健康食品の場合、必要な試験は以下の通りです。
- 3ロット製品の効能成分或は特性成分、衛生学検査、安定性試験
- 3ロット製品の製品技術要求に合致する全項目検査
- 1ロット原料の原料技術要求全項目検査
健康食品届出の推定周期
最初の資料作成とサンプル試験から、最後の許認可取得まで、国産健康食品届出申請の所要周期は5-6ヶ月と推定し、輸入健康食品届出申請の所要周期は8-12ヶ月と推定します。
II. 健康食品の登録
登録申請必要な製品
- 国産製品:「保健食品原料目録」以外の原料を使用する健康食品
- 輸入製品:初回輸入の保健食品(ビタミン・ミネラルなどの栄養物質を補充する栄養素補助剤は除外)
表示可能な保健機能 – 24種
1 | 2 | 3 | 4 |
免疫力増強を助ける | 血脂健康水平の維持を助ける | 血糖健康水平の維持を助ける | 抗酸化を助ける |
5 | 6 | 7 | 8 |
記憶力改善を助ける | 視覚疲労の緩和 | 鉛排出を助ける | のど清涼潤喉 |
9 | 10 | 11 | 12 |
血圧健康水平の維持を助ける | 睡眠改善を助ける | 腸菌群調節を助ける | 体の疲労緩和 |
13 | 14 | 15 | 16 |
耐酸素不足 | 電離放射線危害の補助保護 | 体内脂肪調節を助ける | 潤腸通便を助ける |
17 | 18 | 19 | 20 |
骨密度改善を助ける | 鉄欠乏性貧血改善 | 化学性肝臓損傷の補助保護 | 痤瘡改善を助ける |
21 | 22 | 23 | 24 |
肝斑改善を助ける | 皮膚水分状況改善を助ける | 胃粘膜保護の補助 | 消化を助ける |
登録申請者の資格
- 国産健康食品登録申請者は中国に登録した法人及びその他の組織となります。つまり、国産健康食品登録申請者は製品の製造を委託できます。
- 輸入健康食品登録申請者は国外製造企業(法人格及びその他の組織を指す)となります。つまり、輸入健康食品登録申請者は製品の製造委託できます。
健康食品登録の流れ
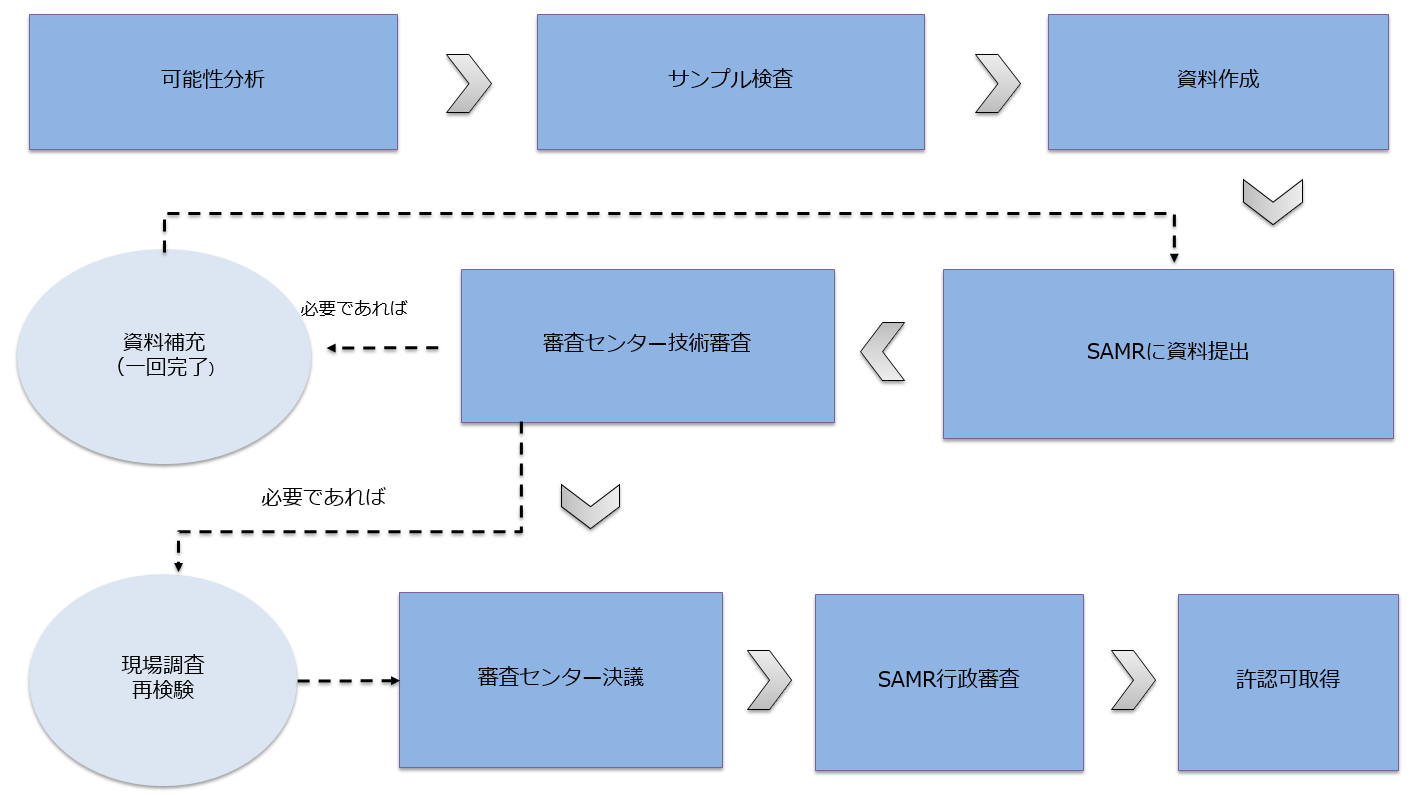
健康食品登録の申請資料
- 登録申請表及び法律責任承諾書
- 登録申請企業主体登記証明資料
- 製品研究開発報告
- 製品処方資料
- 製品製造工程資料
- 製品安全性及び保健効能評価資料
- 保健食品と直接に接触する包装資材の種類、名称、関連標準等
- 製品ラベル、説明書の見本
- 製品名称の相関検索資料
- 包装されるままの最小販売単位のサンプル3件
- 評価に役立つほかの書類
また、輸入健康食品の登録申請は、以下資料を追加しなければなりません。
- 製品製造国(地域)の政府主管部門又は法律サービス機構によって発行した証明書、申請企業が保健食品の海外製造者であることを証明する。
- 製品製造国(地域)の政府主管部門又は法律サービス機構によって発行した証明書、保健食品が1年以上の販売実績があることを証明する。
- 製品製造国(地域)又は国際組織が公布した保健食品製品の技術法規或は関連標準、製造品質管理体系の有効実行を証明できる自己検査報告、良好製造品質管理規範に合致する証明資料。
- 製品製造国(地域)に販売する製品の包装、ラベル、説明書の現物。
- 海外申請企業の常駐中国代表機構によって登録事項を申請する場合、「外国企業常駐中国代表機構登記証」のコピー件を提出する;海外申請企業が中国国内の代理機構を委託して登録事項を申請する場合、公証された委託書の原本及び受託代理機構の営業許可書のコピー件を提出する。
健康食品登録の試験要求
- 3ロット製品の製品技術要求全項目検査
- 3ロット製品の効能成分又は特性成分、衛生学、安定性試験
- 効能成分又は特性成分試験方法の方法学検証
- 1ロット製品の毒性学試験
- 1ロット製品の動物効能試験および(又は)ヒト食用試験
- 他の必要な試験(原料技術要求の全項目検査、保健食品新原料の安全性評価、菌株鑑定、菌種の毒性評価など)
健康食品登録の推定周期
最初の資料作成とサンプル試験から、最後の許認可取得まで、健康食品登録申請の所要周期は2-3年と推定します。



