「中華人民共和国食品安全法」第三十七条によりますと、新食品原料で食品を製造する場合、或は新規食品添加物、食品関連製品の新規品種を製造する場合、企業は国務院衛生行政部門に関連した製品の安全性評価資料を提出しなければなりません。
定義
新食品原料とは、中国において伝統的な食習慣がなし、下記の通りです。
- 動物、植物及び微生物
- 動物、植物及び微生物から分離した成分
- 元の構造に変化が生じた食品成分
- 新しく研究開発したその他の食品原材料
なお、新食品原料は食品原材料の特性があるべき、栄養要求に合致し、無毒、無害且つ人体健康に急性、亜急性、慢性又はその他の潜在的な危険有害性がありません。
関連法規
- 中華人民共和国食品安全法
- 新食品原料安全性審査管理弁法
- 新食品原料申告及び受理規定
- 新食品原料安全性審査規程
新食品原料登録の資料要求
1. 申請書
2. 新食品原料研究開発報告
3. 安全性評価報告
4. 製造工程
5. 執行の関連標準(安全要求、品質規格、検験方法など)
6. ラベル及び説明書
7. 国内外の研究利用状況に関する資料及び安全性評価資料
8. 委託書(登録申請を委託する場合、提供必要)
9. 評価に役立つほかの書類
10. 封印されたままの最小包装の販売サンプル1点又は原材料30g
輸入新規食品原材料の登録を申請する場合、以下の追加書類を提出しなければなりません。
11. 輸出国(地域)の所管部門或は機構によって発行された同国(地域)における製造許可又は販売許可の証明書類
12. 製造企業所在国(地域)の所管機構又は組織によって製造企業の審査又は承認の証明書類
新食品原料登録の試験要求
• 成分分析報告:主要成分と潜在的な有害性成分の検測結果及びその検測方法
• 衛生学検験報告書:代表サンプルの汚染物及と微生物3ロットの検測結果及びその検測方法
• 毒理学評価報告書:
種類 | 必要な毒理試験 |
中国国内外において伝統的な食用習慣がない(微生物を含まず) |
|
個別外国又は中国の部分地域において食用習慣がある(微生物を含まず) |
|
多数の外国において食用を許可されるもの(微生物を含まず) |
|
国内外において伝統的な食用習慣がない微生物 |
|
個別外国又は中国の部分地域において食用習慣がある微生物 |
|
多数の外国において使用を許可される微生物 |
|
• 微生物薬剤耐性試験報告と毒素産生性試験報告:微生物類新食品原料のみに適用
• 安全性評価意見:危害因子の識別、 危害原因の特徴究明、ばくろ評価、リスク判定などを含む
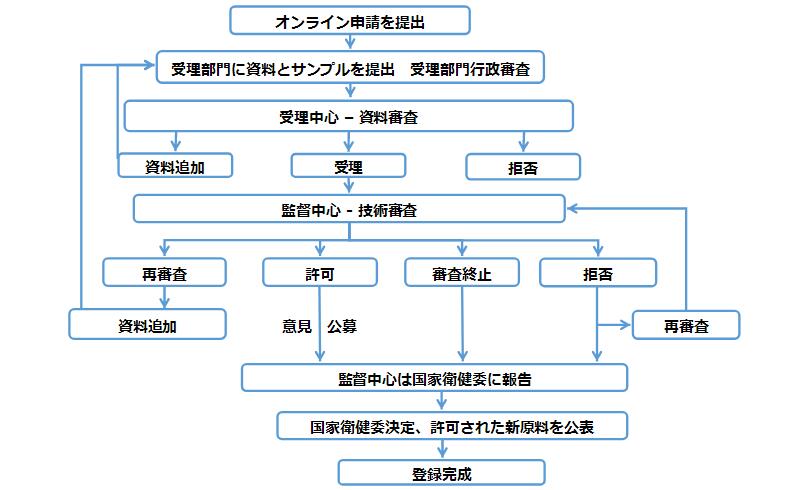
新食品原料登録の流れ
CIRSのサービス
• 新食品原料の法規トレーニング
• 新食品原料の法規動向モニタリング
• 新食品原料登録の代行
• 単項目技術サービス
√ 登録実行性分析
√ 資料ギャップ分析
√ 書類準備
√ 翻訳及び公証
√ 試験手配及び進捗フォローアップ
√ 技術審査答弁
お問い合わせ



