特殊医学用途調整食品登録申請
「中華人民共和国食品安全法」に基づき、特殊医学用途調整食品(FSMP)は中国市場で製造・販売する前に、国家市場監督管理総局(SAMR、元CFDA)に登録申請して許認可を取得しなければなりません。
1.特殊医学用途調整食品とは?
特殊医学用途調整食品(FSMP)とは、特殊対象者が栄養素または食事に対する特殊需要を満足する為に、特別に加工調整して作られた調整食品を指します。一般的に、製品剤形は粉状または液状に分けられます。
2.特殊医学用途調整食品登録申請者の資格
中国国産FSMPの登録申請者は製造能力を有する実際製造企業となります。
輸入FSMPの登録申請者は製造能力を有する海外製造企業となり、しかも、海外製造企業は中国国内代理機構(例えば、CIRSなど)に登録申請事項を委託し、又は海外製造企業の常駐中国代表機構より登録申請事項を執行する必要です。
3.特殊医学用途調整食品登録を管理する中国当局
中国国家市場監督管理総局(SAMR、元CFDA)
4.特殊医学用途調整食品登録に関する法規制
- 特殊医学用途調整食品登録管理弁法
- 特殊医学用途調整食品登録申請材料項目及び要求(試行)(2017年版)
- 特殊医学用途調整食品安定性研究要求(試行)(2017年版)
- 特殊医学用途調整食品ラベル、説明書見本要求(試行)
- 特殊医学用途調整食品製造企業現場審査要点及び判断原則(試行)
- 特殊医学用途調整食品臨床試験品質管理規範(試行)
- 特殊医学用途調整食品臨床試験技術指導原則-糖尿病/腎臓病/腫瘍
- 特殊医学用途調整食品製造許可審査細則
5.特殊医学用途調整食品登録に関する中国国家標準
- GB 25596-2010 食品安全国家標準 特殊医学用途乳児調整食品通則
- GB 25596-2010 公的問答
- GB 29922-2013 食品安全国家標準 特殊医学用途調整食品通則
- GB 29922-2013 公的問答
- GB 29923-2013 食品安全国家標準 特殊医学用途調整食品良好生産規範
6.特殊医学用途調整食品の分類
「GB 25596-2010」及び「GB 29922-2013」に基づき、生後0~12ヶ月に適用される特殊医学用途調整食品は「特殊医学用途乳児調整食品」となります。生後1歳以上の対象者に適用される特殊医学用途調整食品は「全栄養処方食品」、「特定全栄養処方食品」、「非全栄養処方食品」に分けられます。
- 生後0~12ヶ月に適用される特殊医学用途調整食品(特殊医学用途乳児調整食品)
カテゴリー | 適用される特殊医学状況 | 処方の主要技術要求 |
無乳糖処方又は低乳糖処方食品 | 乳糖不耐症乳児 | 1. 処方は、他の炭水化物を利用して乳糖を完全的/部分的に取り換える。 2. 処方中の蛋白質は乳蛋白より提供。 |
乳蛋白部分加水分解処方食品 | 乳蛋白質不耐乳児 | 1. 乳蛋白を加工し、小分子乳蛋白、ペプチド、アミノ酸に分解。 2. 処方は、他の炭水化物を利用して乳糖を完全的/部分的に取り換える可能。 |
乳蛋白高度加水分解処方或はアミノ酸処方食品 | 食物蛋白質不耐乳児 | 1. 処方中に食物蛋白を含有しない。 2. 使用されるアミノ酸の由来は「GB 14880」又は「GB 25596-2010」の要求に合致。 3. あるビタミン・ミネラルの含有量を適当的に調整可能。 |
早産児又は低体重児処方食品 | 早産児/低体重乳児 | 1. エネルギー、蛋白質およびあるビタミン・ミネラルの含有量は「GB 25596-2010」中の4.4の規定より高い。 2. 処方は、消化吸収し易い中鎖脂肪を脂肪の部分由来として使用し、ただし、中鎖脂肪は総脂肪の40%より超えてはならない。 |
母乳栄養補助剤 | 早産児/低体重乳児 | 1. 「GB 25596-2010」中の4.4の必須成分と選択的な成分を選択的に添加可能で、その含有量は早産児又は低体重児の栄養需要および公認の母乳データに基づいて適当的に調整可能。 2. 母乳と共同使用すれば、早産児又は低体重児の成長発育需要を満足できる。 |
アミノ酸代謝異常処方食品 | アミノ酸代謝異常乳児 | 1. 代謝異常のアミノ酸を不含有/少量含有し、他のアミノ酸の組み合わせ及び含有量はアミノ酸代謝異常状況に基づいて適当的に調整できる。 2. 使用されるアミノ酸の由来は「GB 14880」又は「GB 25596-2010」の要求に合致。 3. あるビタミン・ミネラルの含有量を適当的に調整可能。 |
- 生後1歳以上の対象者に適用される特殊医学用途調整食品(全栄養処方食品、特定全栄養処方食品、非全栄養処方食品)
カテゴリー | 定義 | 製品分類 |
全栄養処方食品 | 単一の栄養由来として、適用対象者の栄養需要を満足できる特殊医学用途調整食品 | ― |
特定全栄養処方食品 | 単一の栄養由来として、適用対象者が特定疾病状態又は特定医学状況下の栄養需要を満足できる特殊医学用途調整食品 | (1)糖尿病全栄養処方食品 (2)呼吸器系統疾病全栄養処方食品 (3)腎臓病全栄養処方食品 (4)腫瘍全栄養処方食品 (5)肝臓病全栄養処方食品 (6)筋肉衰退症候群全栄養処方食品 (7)創傷・感染・手術及びその他のストレス状態全栄養処方食品 (8)炎症性腸疾患全栄養処方食品 (9)食物タンパクアレルギー全栄養処方食品 (10)難治性癲癇全栄養処方食品 (11)胃腸吸収不良、膵炎全栄養処方食品 (12)脂肪酸代謝異常全栄養処方食品 (13)肥満・減量手術全栄養処方食品 |
非全栄養処方食品 | 適用対象者部分の栄養需要を満足できる特殊医学用途調整食品 単一の栄養由来としては不適合 | (1)栄養素処方
(2)電解質処方 (3)増稠処方 (4)流動食処方 (5)アミノ酸代謝異常処方 |
7.特殊医学用途調整食品登録申請の資料要求
- 登録申請書
- 製品の研究開発報告書、製品の処方設計及びその根拠
- 製造工程資料
- 製品の標準要求
- 製品ラベル、説明書の見本
- サンプルの試験検査報告
- 研究開発能力、製造能力及び検査能力の証明資料
- 製品安全性、栄養十分性および特殊医学用途臨床効果を表明できる他の資料
- 特定全栄養調整食品を申請する場合、臨床試験報告も提出必要
輸入特殊医学用途調整食品を申請する場合、以下の資料を追加しなければならない
- 製品製造国(地域)政府主管機構又は法律サービス機構より発行した証明書のコピー件及び中国語翻訳件、申請者がFSMP製品の域外製造者であることを証明する。
- 製品製造国(地域)政府主管機構又は法律サービス機構より発行した証明書のコピー件及び中国語翻訳件、同FSMP製品が域外市場にての販売を許可することを証明する。同FSMP製品が販売実績がない場合、提出不要。
- 域外申請者の中国国内拠点より登録申請事項を執行する場合、「外国企業常駐中国代表機構登記証」のコピー件を提出する。
- 域外申請者が中国国内の代理機構を委託して登録申請事項を執行する場合、公証された委託書の原本及び中国語翻訳件、委託された代理機構の営業許可書のコピー件を提出する。
8.特殊医学用途調整食品登録申請の試験報告要求
試験項目 | 説明 |
サンプルの試験検査報告 | ● 製品標準要求中の全ての項目を含む。例えば、ビタミン、ミネラル、重金属など。 ● 3ロットのサンプルで試験を行う。 |
安定性試験 (影響要素試験) | ● 高温試験、高湿試験、光照試験を含む。 ● 1ロットのサンプルで試験を行う。 |
安定性試験 (加速試験) | ● 試験時間は製品賞味期限の1/4となり、しかも3ヶ月以下にしてはならない。 ● 3ロットのサンプルで試験を行う。 |
安定性試験 (長期試験) | ● 予期の賞味期限以上の時間となければならない。 ● 3ロットのサンプルで試験を行う。 |
臨床試験 | ● 特定全栄養調整食品のみが必要。 |
*注:特殊医学用途調整食品登録を初回申請する際に、製品カテゴリーに基づき、提出しなければならない試験報告は違う。
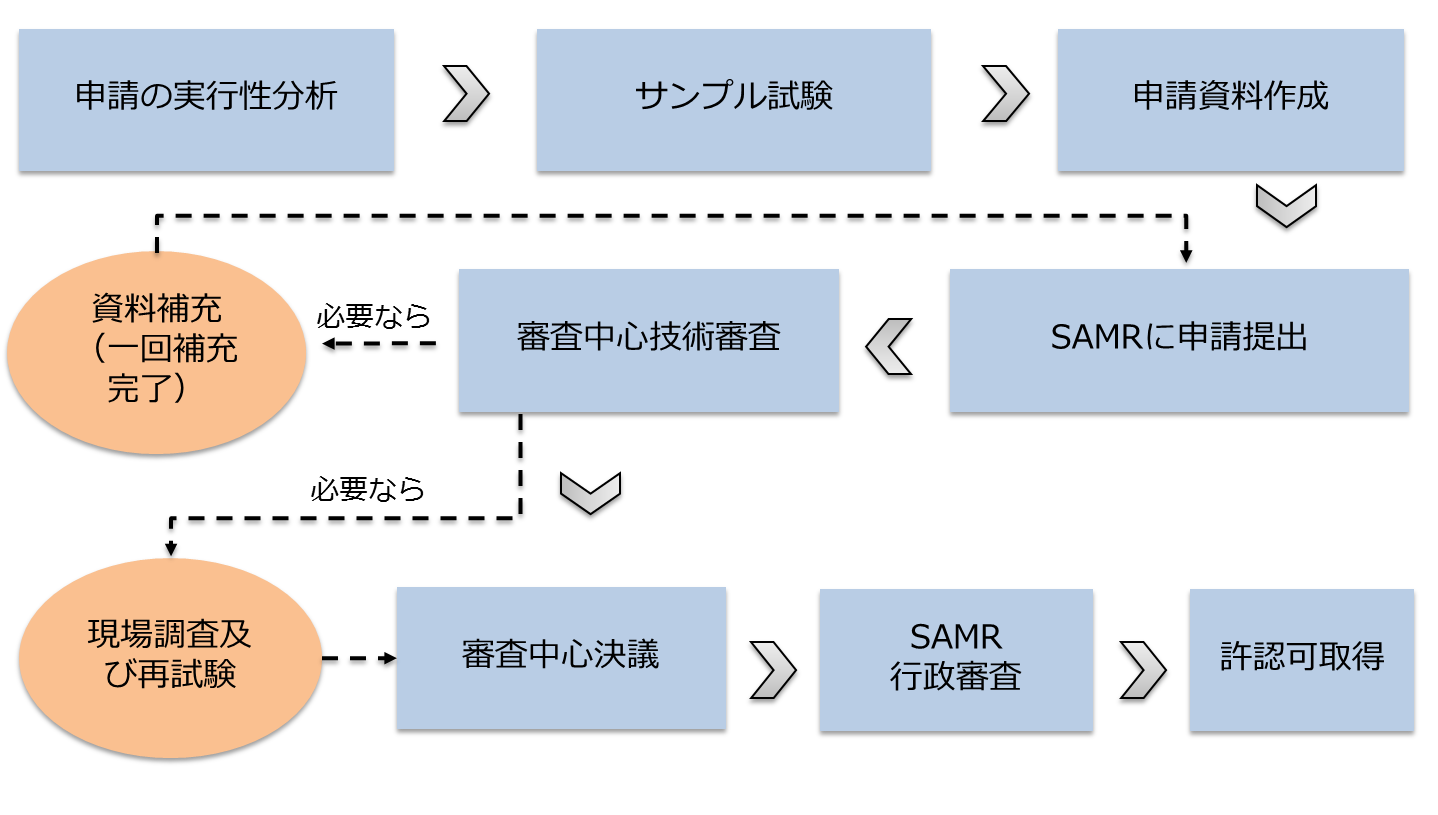
9.特殊医学用途調整食品登録申請の流れ
10.特殊医学用途調整食品登録申請の推定周期
最初の資料編集および試験検測から中国当局の技術審査まで、一般的に、全栄養処方食品、非全栄養処方食品、特殊医学用途乳児調整食品の登録申請周期は1-2年が必要だと予測し、特定全栄養処方食品は臨床試験が必要なので、登録申請周期は3年以上が必要だと予測します。
CIRSのザービス
CIRSはお客様にワンストップの中国食品法規制対応サービスを提供します。特殊医学用途調整食品(FSMP)に対し、以下のサービスを提供します。
- FSMP類別分析および処方審査
- 中国語ラベルおよびパッケージの設計
- 翻訳及び公証
- 試験手配及び進捗フォローアップ
- その他の最適化サービス



