中国国家市場監督管理総局(SAMR)が2023年8月31日に公布した「保健食品表示可能な保健機能目録 非栄養素補充剤類(2023年版)」(以下は「2023年版機能目録」)及びそのシリーズ規制の公告に基づき、旧版時代保健食品許認可の「引き換え」政策はついに開始します。中に、企業が最も注目するのは「双無」(有効期限無し・製品技術要求無し)製品の「引き換え」に違いません。
1996年から2005年7月1日まで、元中国衛生部と元中国国家食品薬品監督管理局(CFDA)は総計10,000弱の「双無」製品を認可しました。この度、CIRSは「双無」製品についてまとめ、企業が「双無」製品の状況を了解し、「引き換え」の事前準備にサポートできると期待しております。
1. 1996年~2005年に登録認可した保健食品
統計によりますと、1996年から2005年7月1日まで、登録認可した保健食品は総計8,345件あります。中に、国産製品は7,802件あり、輸入製品は543件あります。
注:「双無」製品の保健機能数量は1個から5個まであり、統計便利の為に、同一許認可の複数保健機能は重複計算する。SAMR公的サイトに保健機能を開示していない「双無」製品は統計しない。
「2023年版機能目録」に収載し、効能学試験を再び進行/追加進行する必要な8類保健機能の製品は総計5,385件(国産製品5,089件、輸入製品296件)あり、許認可総件数の64.5%を占めます。効能学試験を再び進行/追加進行する不要な16類保健機能の製品は総計1,975件(国産製品1,873件、輸入製品102件)あり、許認可総件数の23.7%を占めます。
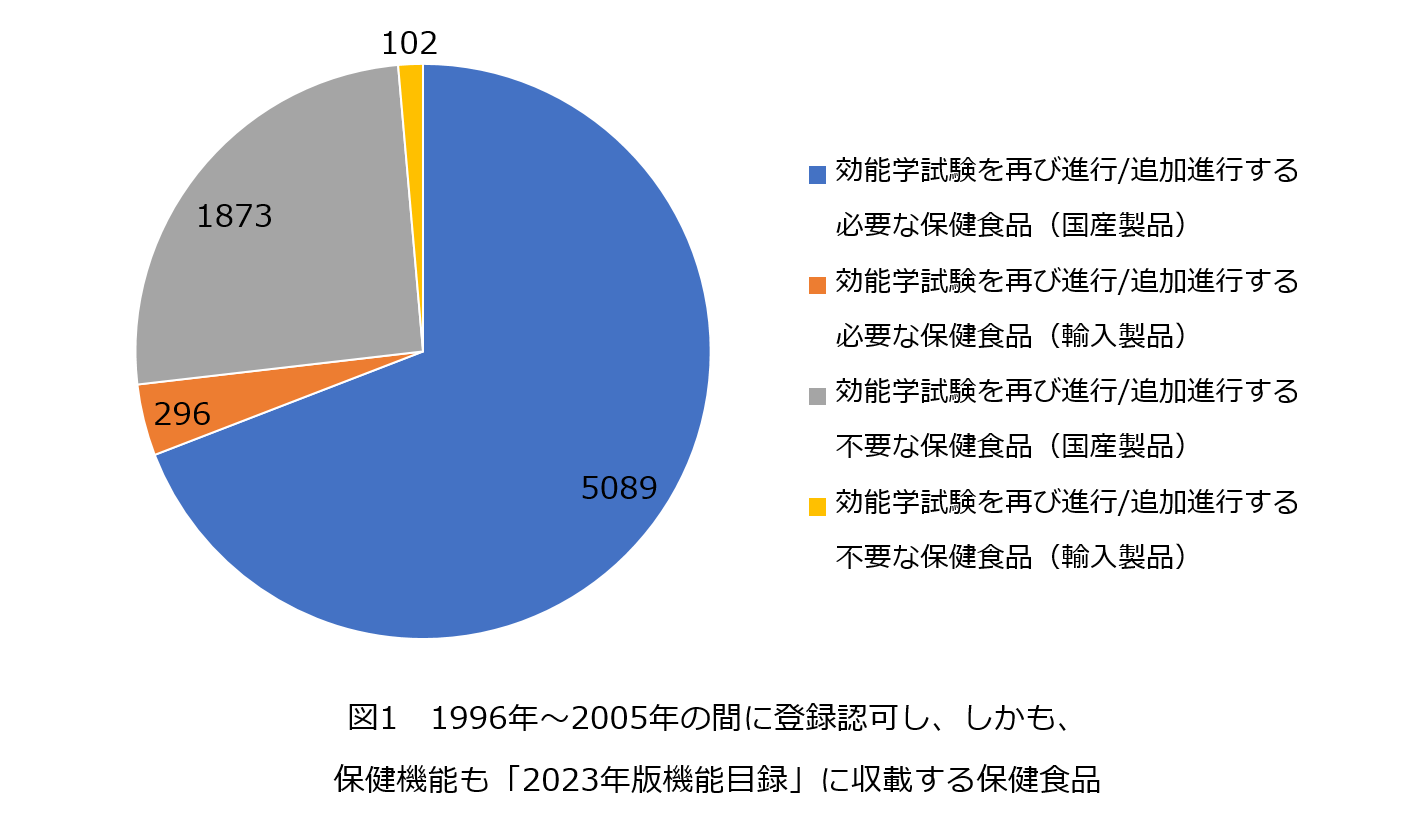
「2023年版機能目録」に収載していない保健食品件数は、許認可総件数の11.8%を占めます。中に、保健機能が「栄養素補充」となる製品は総計804件(国産製品680件、輸入製品124件)あり、これらの許認可は「保健食品届出申請」のルートに従って「引き換え」を対応できます。ほか状況の製品は総計181件(国産製品160件、輸入製品21件)あり、その保健機能は抗異変、微小循環改善などのキャンセルされた機能を含み、これらの許認可は「保健食品新機能申請」のルートに従い、或は「2023年版機能目録」に収載する保健機能に転換した後に、「引き換え」を完成できます。
2. 1996年~2005年に登録認可し、しかも、効能学試験を再び進行/追加進行する不要な保健食品
効能学試験を再び進行/追加進行する不要な16類保健機能の製品では、中に、「胃腸機能改善(潤腸通便)」類の許認可は346件あり、数から見ると第一位です。次は「睡眠改善」類の許認可と「血糖調節、血糖低下」類の許認可であり、それぞれは256件、250件あります。
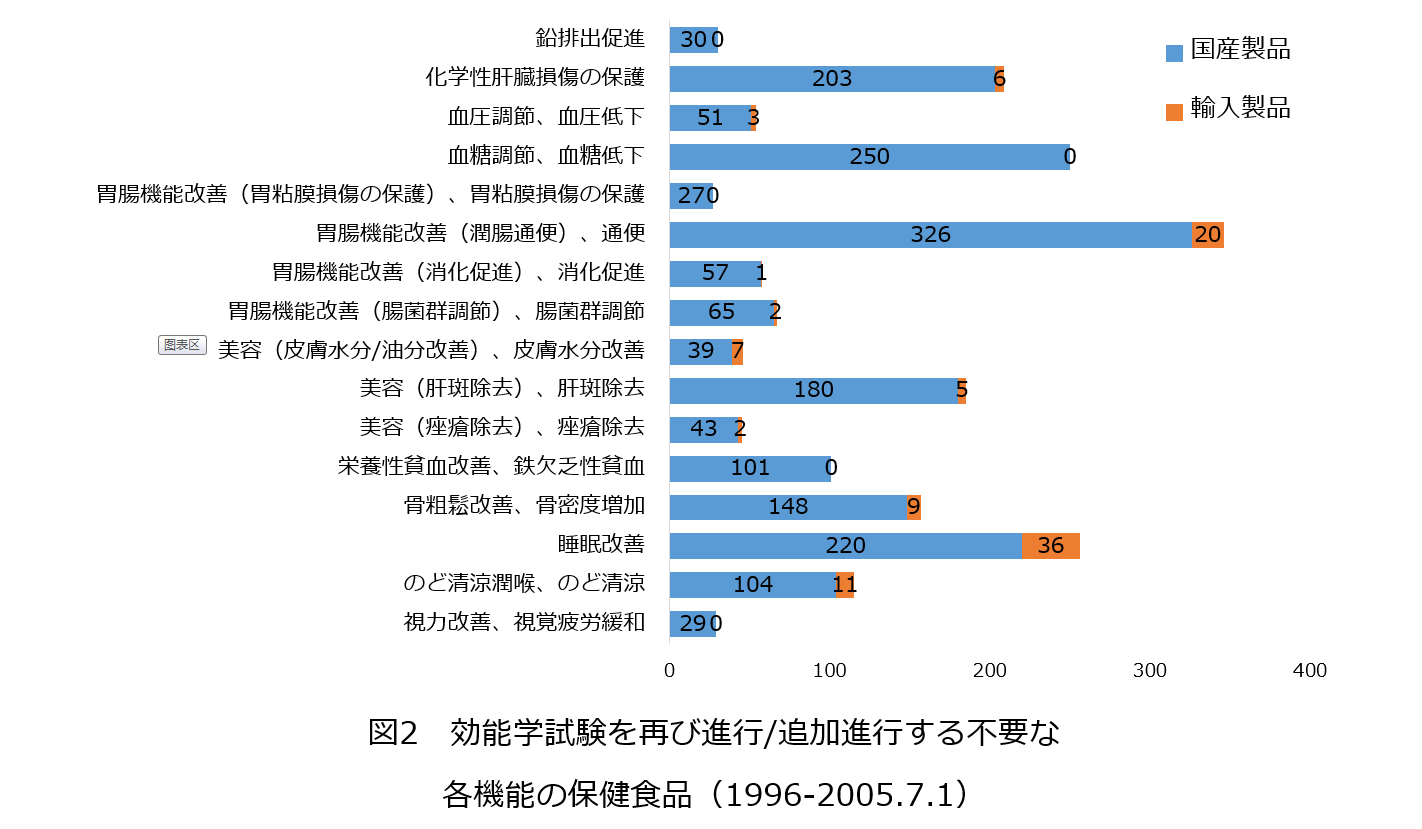
国産製品は総計1,873件あり、中に、「胃腸機能改善(潤腸通便)、通便」類の許認可は326件あり、数から見ると第一位です。次は「血糖調節、血糖低下」類の許認可と「睡眠改善」類の許認可であり、それぞれは250件、220件あります。数が最も少ないのは「胃腸機能改善(胃粘膜損傷の保護)、胃粘膜損傷の保護」類の許認可であり、27件のみです。
輸入製品は総計102件あり、中に、「睡眠改善」類、「胃腸機能改善(潤腸通便)、通便」類、「のど清涼潤喉、のど清涼」類の許認可が多くて、それぞれは36件、20件、11件あります。
3. 1996年~2005年に登録認可し、しかも、効能学試験を再び進行/追加進行する必要な保健食品
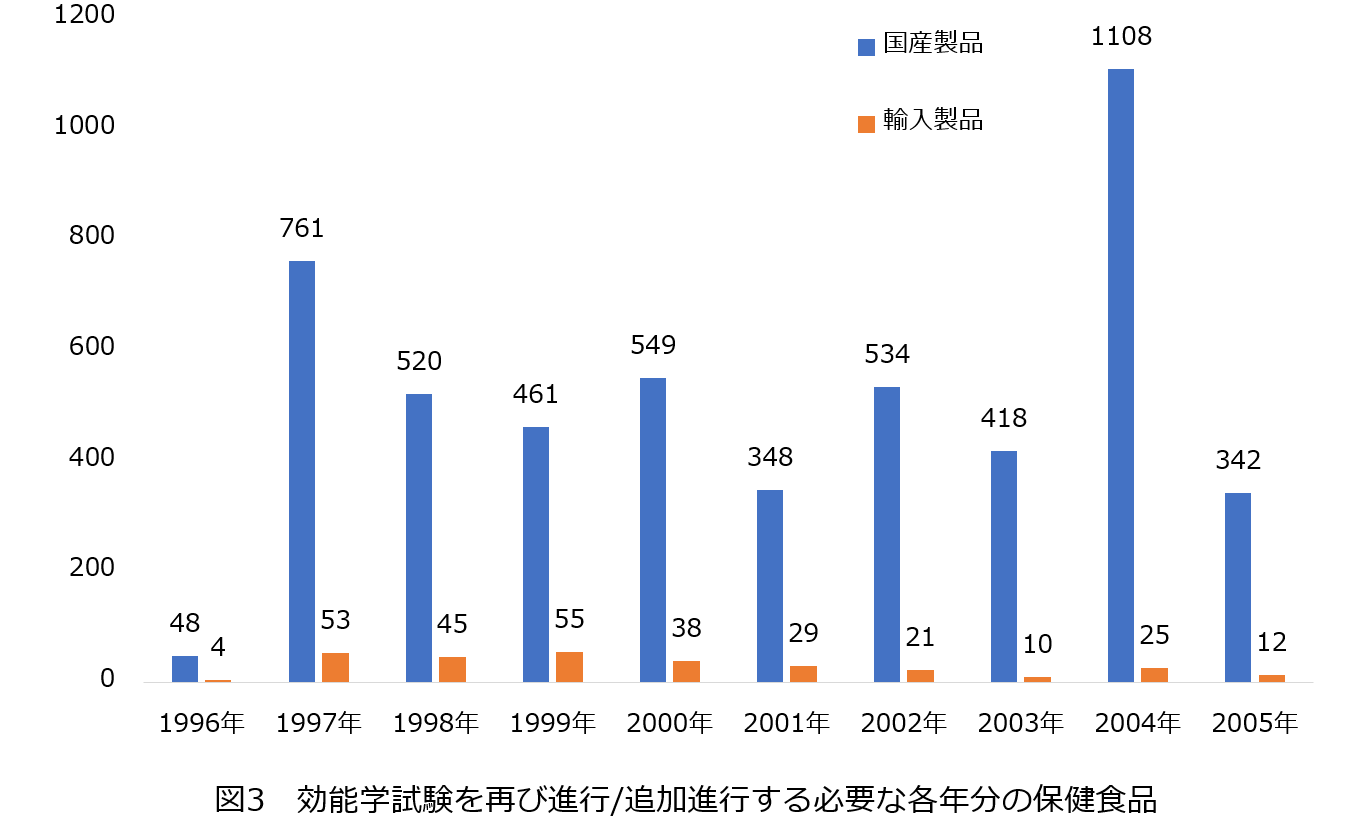
効能学試験を再び進行/追加進行する必要な8類保健機能の製品では、登録許認可取得年分から見ると、2004年の許認可は1,133件あり、数から見ると第一位です。次は1997年と2000年の許認可であり、それぞれは814件、587件あります。
保健機能別から見ると、「免疫調節、免疫力増強」類の許認可は2,167件あり、数から見ると第一位です。次は「抗疲労、体疲労緩和」類の許認可と「血脂調節(総コレステロール低下、トリグリセリド低下)、血脂低下」類の許認可であり、それぞれは1,081件、992件あります。
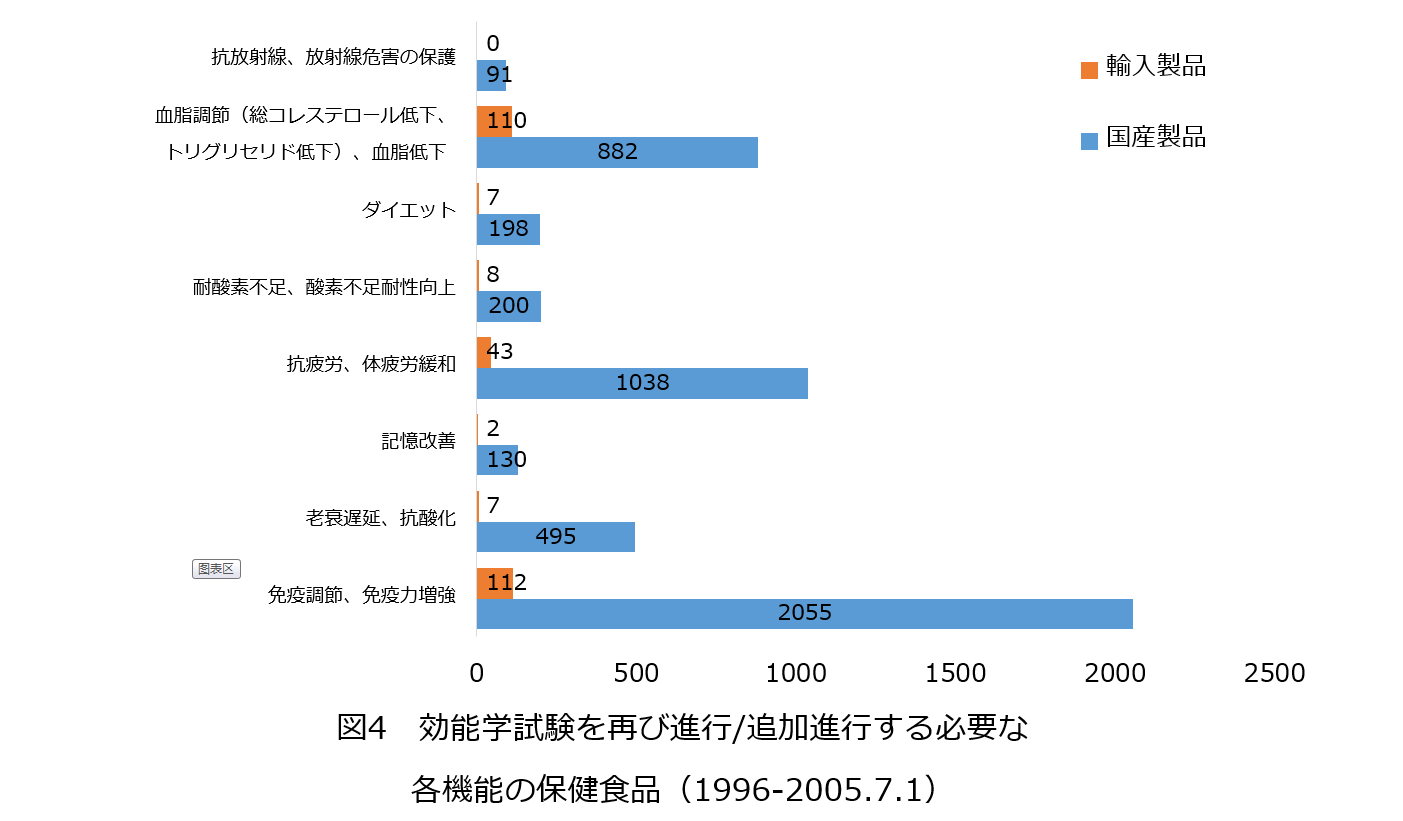
国産製品は総計5,089件あり、中に、「免疫調節、免疫力増強」類の許認可は2,055件あり、数から見ると第一位です。次は、「抗疲労、体疲労緩和」類の許認可と「血脂調節(総コレステロール低下、トリグリセリド低下)、血脂低下」類の許認可であり、それぞれは1,038件、882件あります。
国産製品は総計296件あり、中に、「免疫調節、免疫力増強」類の許認可は112件あり、数から見ると第一位です。次は、「血脂調節(総コレステロール低下、トリグリセリド低下)、血脂低下」類の許認可と「抗疲労、体疲労緩和」類の許認可であり、それぞれは110件、43件あります。
まとめ
1996年から2005年7月1日まで、総計8,345件の保健食品は許認可取得しました。中に、効能学試験を再び進行/追加進行する必要な8類保健機能の製品は総計5,385あり、その中に、「免疫力」類保健機能の製品が一番多いです。「引き換え」政策に基づき、もし、製品の効能学評価試験の根拠が「保健食品効能学評価プロセスと検験方法(1996年版)」であれば、効能学試験を再び進行/追加進行する必要です。もし、製品が既に「保健食品検験及び評価技術規範(2003版)」又は2012年「抗酸化効能評価方法など9つの保健効能評価方法の公布に関する通知(国食薬監保化〔2012〕107号)」に従って効能学評価試験を対応済みであれば、効能学試験を再び進行/追加進行する不要です。
「2023年版機能目録」及びそのシリーズ規制の公告に基づき、既に登録認可した「双無」製品に対し、省レベルSAMRは製品実際製造する時の技術要求と監督管理状況に基づき、現行法規制に従って製品「引き換え」の意見を発行します。従いまして、登録許認可取得後ずっと製造・販売していない製品なら、実際の製造・販売を行った後に、また「引き換え」対応できると考えております。
CIRS食品事業部は中国保健食品登録・届出分野に豊富的な対応経験あります。各保健食品許認可の状況に基づき、「引き換え」政策の要求に従い、保健食品許認可の「引き換え」を全般対応できます。詳しくはこちらにてご確認ください。
注:
- 本文データ由来:中国国家市場監督管理総局(SAMR)公的サイト
- 統計製品:1996年~2003年元中国衛生部が認可した製品、及び2003年~2005年7月1日元中国国家食品薬品監督管理総局(CFDA)が認可した製品
- 「双無」製品の保健機能数量は1個から5個まであり、統計便利の為に、同一許認可の複数保健機能は重複計算する。SAMR公的サイトに保健機能を開示していない「双無」製品は統計しない。
- SAMR公的サイトは不定時的に更新するので、本文データは参考のみ。
関連ニュース
- 「食規査」新機能立ち上げー保健食品法規標準データベース 法規制を楽に検索
- 中国国家衛生健康委員会 9件の漢方薬原料を食薬両用リストに正式に追加
- 中国SAMR公的FAQ:保健食品よく見られる問題及び共通性問題に関する返答まとめ
- 5年ぶり!保健食品効能評価方法ついに施行!新規制の主要変化と登録類保健食品の試験要求
CIRSサービス



