消毒製品の定義:
「中華人民共和国伝染病予防治療法」の第78条によると、消毒は化学的、物理的、生物的な方法を使って環境中の病原微生物を殺す又は消滅することです。
使用目的から見ると、消毒製品は治療又は病気を診断する製品ではなく、病気を予防する製品であります。作用機序から見ると、薬理学又は免疫学の方法で病気を予防する製品ではなく、化学的、物理的、生物的な方法を使って病原微生物を消滅する製品であります。作用対象から見ると、ヒトの病気を対象としての製品ではなく、環境中の病原微生物を対象とするものであります。
「消毒管理弁法」第46条によると、消毒製品は消毒剤、消毒機器(生物指示物、化学指示物、菌を消滅する製品の包装物を含む)衛生用品と使い捨て医療用品になります。
消毒製品の分類と管理
中国では化粧品製品の用途、使用対象のリスク程度によって分類管理を行います。製品の責任単位は製品が上市発売される前に第1、2類消毒製品に対して自己又は第三者に依頼して衛生安全評価を行い、そしてその結果に責任を負います。
第一類:高リスクを有する、安全性と有効性を確保するために厳密な管理が必要な消毒製品。医療機器に運用するハイレベルの消毒剤と消毒機器、滅菌剤と滅菌機器、皮膚粘膜消毒剤、生物指示物、滅菌効果を有する化学指示物が含まれます。
第二類:中度リスクを有する、安全性と有効性を確保するために管理の強化が必要な消毒製品。第1類消毒製品以外の消毒剤、消毒機器、化学指示物、及び滅菌表示がある滅菌物品の包装物、抗菌(菌抑制)剤が含まれます。
第三類:リスクは低い、通常の管理を行えば製品の安全性と有効性が保証できる抗菌(菌抑制)剤以外の衛生用品になります。
注:1つの消毒製品が同時に各類別に所属する場合、リスク高い類の製品として管理されます。
備案の法律根拠
「消毒管理弁法」「消毒製品衛生安全評価規定」「新消毒製品・新水関係衛生安全製品衛生行政許可管理規定」等
主管部門
各省(市、区)衛生と計画生育委員会
消毒製品備案流れ図
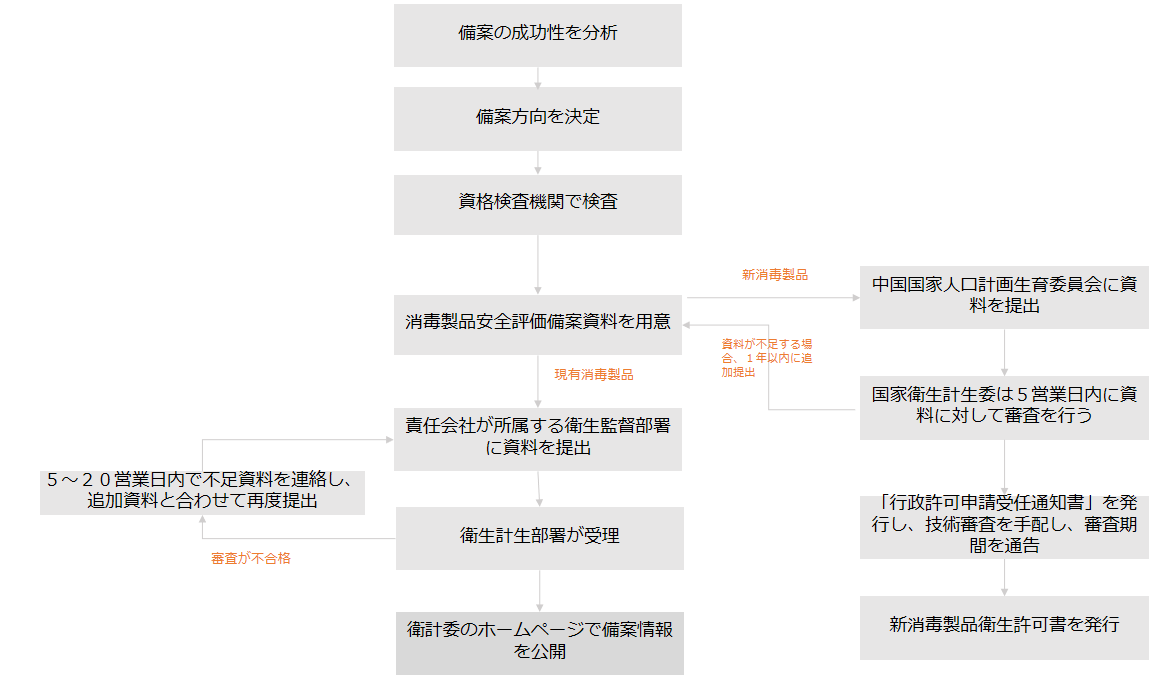
備案資料要求
消毒製品の備案資料について通常以下の物が必要とされます:消毒製品安全評価報告備案登記表、消毒製品衛生安全評価報告、ラベル、説明書、検査報告等の基本資料。国産化粧品について国産消毒製品企業衛生許可証が必要となります。輸入製品について輸入製品生産国(地域)の生産販売承認等の資料が必要とされます。
備案試験要求
消毒製品が備案時に使用される検査報告書について、資格を持つ検査機関が発行するものしか使用できません。それと、「消毒製品衛生安全評価技術規範」等の関連法規制を遵守すべきです。製品の検査報告について以下の内容を含む:
- 微生物汚染指標
- 物理・化学実験
- 毒性学試験
- 微生物を殺す又は菌抑制実験の報告書等
全部の検査項目は同じロット製品で完成すべき、補充試験ついて違うロット製品で行っても問題ありません。それと有効成分の含有量、Ph値を再度測定する必要があります。中に有効成分が純物ではない化学成分について、1つ抗力最強の微生物殺す(又は抑制)試験とPh値を再度測定しなければなりません。
上市販売された消毒製品について以下の変更がある場合、製品の責任申請単位が関連検査項目を再度検査を行い、評価資料を更新しなければなりません:
a)実際の生産場所の移転、他の生産工場又は仕事場の設立、委託生産・委託加工の移管があった場合;
——a)に該当する場合、消毒剤と抗菌(菌抑制)剤について有効成分の含有量、原液安定性試験、Ph値試験を行うべき、消毒機器について殺菌因子強度測定を行うべき、殺菌因子の測定条件を揃えない試験について現場の模倣試験を行います。生物指示物は菌の含有量測定を行い、化学指示物について色変化の測定を行い、菌の消滅表示がある包装物について菌の消滅因子の透過性能試験を実施します。
b)消毒剤、抗菌(菌抑制)剤、生物指示物、化学指示物、菌の消滅表示がある包装物及びPCDの有効期間が延長された場合;
——b)に該当する場合、消毒剤と抗(抑制)菌は有効成分の含有量、Ph値、1つ抗力最強の微生物殺す(又は抑制)試験と安定性試験を実施し、安定性試験について以前送ってもらたサンプルを使って試験を行います。生物指示物、化学指示物とPCDは安定性試験を行い、菌の消滅表示がある包装物について包装材料の有効期間試験を実施します。
c)消毒剤、消毒機器と抗(抑制)菌剤の使用範囲が増加又は使用方法が変更する場合;
——c)に該当する場合、相応する物理・化学、微生物を殺す(又は抑制)と毒性試験を実施します。
d)第一類消毒製品の衛生安全評価報告が4年の有効期間を過ぎる前に:
——d)に該当する場合、消毒剤の有効成分の含有量、Ph値と1つ抗力最強の微生物殺す試験を実施しなければなりません。とPh値を再度測定しなければなりません。消毒機器について主要殺菌因子強度と1つ抗力最強の微生物殺す試験を実施し、生物指示物は菌の含有量測定を行い、化学指示物について色変化の測定を行います。
備案ラベル要求
「消毒製品ラベル説明書通用要求」によると,消毒製品の最小販売包装のラベルに以下の内容が必要となります:
- 製品名称;
- 含有量;
- 製品規格(錠剤の場合明記);
- 主要有効製品および含有量;
- 使用範囲;
- 生産日及び有効期間又は生産ロット及び使用終了日;
- 生産企業名称、住所、連絡先;
- 国産製品の生産企業衛生許可番号;
- 輸入製品の原産国又は地域名称;
- 貯蔵条件。
CIRSの強み
- 化粧品業界の川上/川下企業にワンストップサービスを提供
- 製品の安全性とコンプライアンス
- 製品の迅速な市場投入
- 豊富な経験を持つ毒性学の専門家と法規チーム
- グローバルのパートナーシップ
- 厳格な秘密保持制度



