保健食品備案信息系統(届出システム)は2017年5月1日に運行開始しました。2021年2月22日まで、総計123件の輸入保健食品(未公開の許認可取得した製品もあるので、実際の件数は123件以上となる)は許認可を取得しました。届出申請可能な保健食品の剤形は「保健食品届出製品主要製造工程(試行)」等の法規制要求に合致しなければならないので、現時点、届出類保健食品の剤形はタブレット錠剤、硬カプセル、軟カプセル、内服液及び顆粒剤だけです。
保健食品の届出管理制度は行政審査の流れを簡略化し、企業の負担を減少します。中国国家市場監督管理総局(SAMR)は「簡政放権」(政府効率化、地方分権化)の政策に答えるために、より多くの保健食品を届出申請可能にさせるはずです。2021年2月20日、SAMRは「保健食品届出製品剤形及び技術要求(2021年版)」及び「保健食品届出製品に使用可能な補助原料及びその使用規定(2021年版)」(以下は、「2021版補助原料目録」と略称する)を正式に公表し、グミキャンデー及び粉剤を保健食品届出申請可能な剤形に収載しました。相関法規制は2021年6月1日から正式に施行されます。
今まで届出申請可能な剤形と異なり、グミキャンデー及び粉剤は食品形状に属します。企業が中国保健食品届出相関規制の要求をしっかり把握することを目的として、この度、グミキャンデー剤形の輸入保健食品を実例として、輸入保健食品の届出申請流れ、届出申請に所要な証明書類及び資料要求、及び届出申請の注意事項を重点的に紹介します。
輸入保健食品届出申請の流れ

以上は保健食品届出システムアカウント申請及び製品届出申請の流れの簡略図となります。輸入保健食品の届出を初回申請(申請資料を提出)する前に、まず、申請企業は届出システムのアカウント(以下は、「届出アカウント」と略称する)を申請して取得しなければなりません。届出アカウントを取得した後に、製品届出申請資料のオンライン提出が可能になります。一般的に、全てが順調的に進行する場合、資料準備から製品届出許認可取得まで、全周期は8ヶ月程度です。中に、時間が掛かるのは証明書類の発行、サンプルの安定性試験、当局の技術審査、資料補充及び二回技術審査です。一般的に、届出申請の全周期を短縮するために、届出アカウントの申請及び保健食品製品の届出申請の準備を同時開始し、届出アカウントを取得した後に、製品届出のオンライン申請を即時に提出するやり方を提案します。これは最も迅速的な操作だと思っております。それに、サンプル検査及び証明書類等の資料の準備も同時に進行すれば、届出申請の全周期を更に短縮することができます。
届出アカウントの申請及び製品届出の申請は、まずは公的ウェブサイトでオンライン申請を提出し、審査通過した後に書類資料を現場提出しなければなりません。オンライン申請の第一歩は、公的ウェブサイトの「获取登录账号」(登録アカウント取得)をクリックして、保健食品届出アカウントを申請します。オンライン申請の第二歩は、取得した届出アカウントを利用して届出システムにログインし、保健食品製品の届出申請を提出します。ウェブサイトのホームページは以下の通りです。
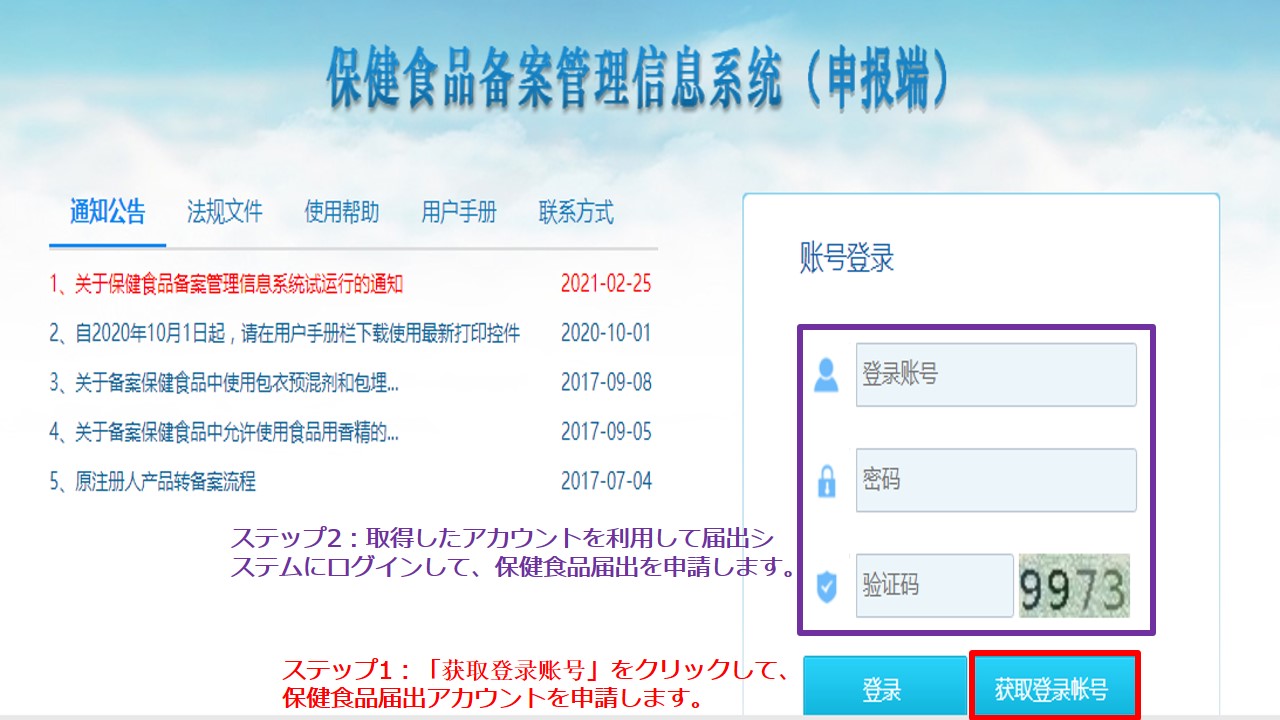
ステップ1:「获取登录账号」をクリックして、以下のページに入ります。要求に従って企業情報を記入し、相関証明資料をアップロードし、アカウントを申請します。
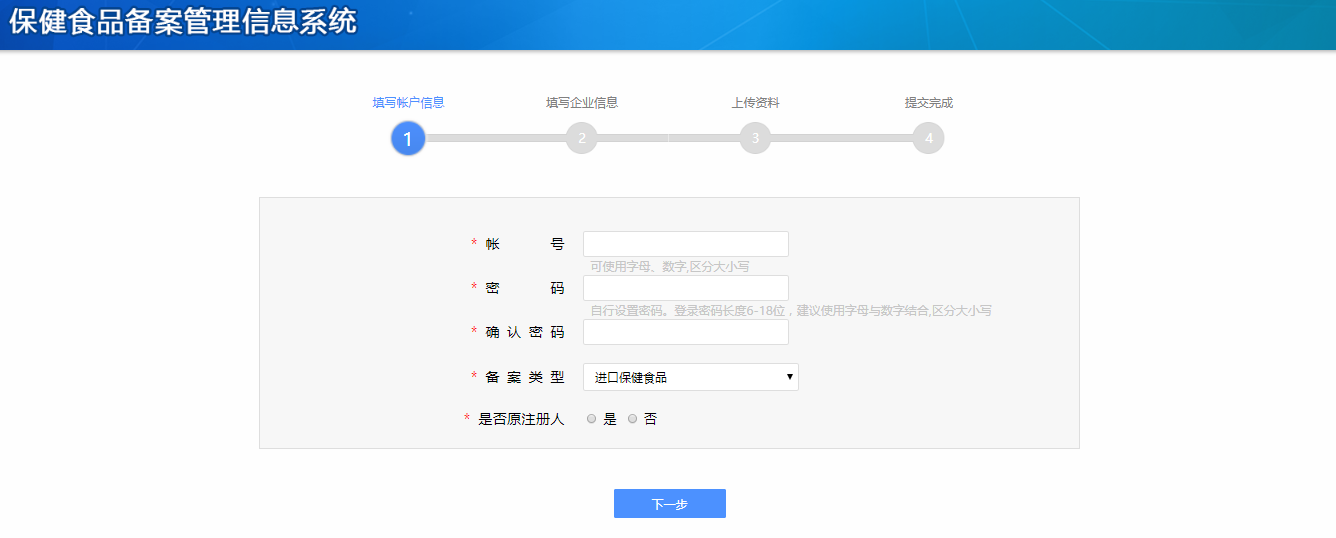
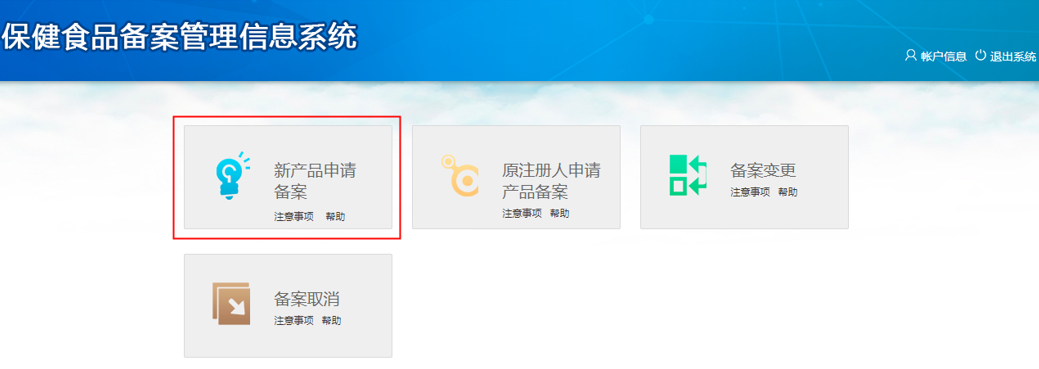
ステップ2:取得したアカウントを利用して届出システムにログインし、以下のページに入ります。「新产品申请备案」をクリックして、「备案申请」をクリックします。要求に従って製品情報、製造企業情報、域内申請機構情報を記入し、製品に関する資料をアップロードします。こうすると、保健食品届出許認可の申請は完成します。

タブレット(錠剤)、硬カプセル、軟カプセル、内服液或は顆粒剤剤形の保健食品であっても、グミキャンデー或は粉剤剤形の保健食品であっても、輸入保健食品として届出申請の流れは同じです。企業は保健食品届出申請の流れをしっかり把握する以外、届出アカウントの申請及び保健食品製品の届出申請に所要な証明資料及び相関資料に対する了解も重要的です。資料が相関要求に合致しない場合、届出申請の流れは乱される恐れがあります。ここに、CIRSは法規制要求及び対応経験に基づき、関連した資料要求を整理し、届出申請の実際操作に関する注意事項を示します。
まず、申請企業の届出アカウント申請に所要な証明資料は以下の通りです。
1. 製品製造国(地域)、政府主管機構又は法律サービス機構によって発行した申請企業が保健食品の域外製造者(所在国/地域の要求に合致する法人格或はその他の組織)であることを証明する証明書
2. 保健食品届出アカウント申請連絡者授権委託書
3. 届出申請企業法人代表パスポートのスキャン件
上述した証明資料について、注意すべきポイントがあります。例えば、パスポートのスキャン件はカラーであり、はっきりしなければなりません。連絡者授権委託書に法人代表のサインがあれば、サインとパスポートは一致にして、漏れてはいけません。
輸入保健食品製品の届出申請について、所要な資料及び証明資料の要求は以下の通りです。
1. 届出申請書、及び申請者が提出される資料の真実性に責任を負う法律責任承諾書
2. 届出申請者主体の登記証明資料(国産保健食品:営業許可書、保健食品製造許可書等。輸入保健食品:製品製造国(地域)政府主管機構又は法律サービス機構によって発行した申請者が保健食品の域外製造者であることを証明する証明書)
3. 製品配合資料:製品の配合処方
4. 製品製造工程資料、例えば、製造工程の簡略図及びその説明
5. 製品安全性及び保健効能評価資料
5.1 3ロットのパイロット以上規模で製造される製品の効能成分或は特性成分、衛生学検査、安定性試験報告
5.2 原料補助原料合理使用の説明、及びラベル説明書、製品技術要求の制定が相関法規制に合致する説明
6. 保健食品と直接に接触する包装材の種類、名称、関連標準
7. 製品ラベル、説明書の見本
8. 製品技術要求資料
9. 資格ある試験機構によって発行した製品技術要求に合致する全項目検査報告
9.1 食品試験機構の資格証明資料
9.2 3ロットの製品技術要求に合致する全項目検査報告
10. 製品名称の相関検索資料
11. 製品安全性及び保健効能を表明できるほかの資料
輸入保健食品製品の届出申請は、以下の資料を追加提出しなければなりません。
12. 届出申請者主体の登記証明資料(製品製造国/地域の政府主管機構又は法律サービス機構によって発行した申請者が保健食品の域外製造者であることを証明する証明書)
13. 保健食品が1年以上の販売実績ある証明資料(製品製造国/地域の政府主管機構又は法律サービス機構によって発行した保健食品が1年以上の販売実績があることを証明する証明書、或は製品が域外における販売及び対象者食用状況の安全性報告)
14. 製品製造国(地域)又は国際組織が公布した保健食品製品に関わる技術法規或は関連標準、製造品質管理体系の有効実行を証明できる自己検査報告、良好製造品質管理規範に合致する証明資料
15. 製品製造国(地域)に販売する製品の包装、ラベル、説明書の現物、中国語翻訳及び公証書
16. 域外申請者の中国代表機構によって届出を申請する場合、「外国企業常駐中国代表機構登記証」のスキャン件を提出します。域外申請者が中国域内の代理機構を委託して届出を申請する場合、公証された委託書の原本及び委託される代理機構の営業許可書のスキャン件を提出します
現時点に届出申請可能な製品剤形(タブレット、硬カプセル、軟カプセル、内服液或は顆粒剤)は、何れも現行の「中華人民共和国薬局方」に収載される剤形であるので、製品技術要求の指標設定は「中華人民共和国薬局方」及び「GB 16740-2014 食品安全国家標準 保健食品」を参考すべきです。それに対し、グミキャンデー及び粉剤は食品形状に属し、その技術指標は相応した中国国家標準がありません。その同時、グミキャンデー及び粉剤剤形の保健食品が届出申請する際に使用可能な補助原料も、現時点に届出申請可能な製品剤形の相関規定と少々違います。従いまして、法規制はこの2つの剤形の保健食品が届出申請する際に使用可能な補助原料、技術要求に対して特別的な要求を規定しています。
以下はグミキャンデー剤形の保健食品を実例として、届出申請する際に使用可能な補助原料、技術要求等の重要内容を説明します。
グミキャンデーの概述
保健食品として届出申請可能なグミキャンデーは、保健食品原料目録に収載される原料、及び食用糖或はシロップ或は甘味料、食用ゼラチン(或は澱粉)等の補助原料を利用し、相関工程で製造され、弾性及び咀嚼性を有するキャンデーです。
グミキャンデー製品説明書に関する重要内容
説明書内容 | 相関要求 |
適用対象者 | 4歳以上 |
食用量及び食用方法 | 毎日最大食用量は「20g」となる。 食用方法は「十分的に咀嚼した後に食用」となる。 |
規格 | 毎粒は6g以下 |
注意事項 | 飲み込まないでください。 本品を食用する対象者は固体食物を咀嚼する能力を備えるべき。 その同時、適用対象者に「13歳以下」を含む場合、「大人の監督下に十分的に咀嚼して食用」というお知らせを増やすことを推薦する。 |
グミキャンデー類製品の技術要求
グミキャンデー類食品の特徴に基づき、関連した法規制はグミキャンデー類製品の官能要求、物理化学指標、微生物指標に対して具体的な要求(その他の特別的な相関要求がある原料又は補助原料を使用する場合は、相応した要求にも合致しなければならない)を規定します。ここに物理化学指標を実例として、要求を説明します。
| 指標の量で計算)、mg/kg | ≤0.5 |
ヒ素(Asの量で計算)、mg/kg | ≤0.5≤0.3g/100g | 植物ゼラチン型:≤18.0 動物ゼラチン型:≤20.0 澱粉型:≤18.0 混合型:≤35.0 サンドイッチ型、コーティング型、コーティングして艶出し型:主体キャンデーの要求に合致 無糖ゼラチン型グミキャンデーはこの指標を設定しない |
グミキャンデーの主要製造工程
ゼラチン融化、糖化、熬煮、混合、調製、濾過、膨張、成型、乾燥、撹拌、コーティング、艶出し、糖衣かけ、包装など
グミキャンデー剤形の適用範囲
現時点に保健食品原料目録に収載されるビタミン・ミネラルを原材料とする製品は、グミキャンデー剤形に加工される可能です。
使用可能な補助原料
「2021版補助原料目録」は総計197件の届出類保健食品に使用可能な補助原料を規定します。グミキャンデーは食品形状なので、その使用可能な補助原料は総計151件であり、カプセル、タブレット、顆粒剤等のその他の剤形より少ないです。例えば、四酸化三鉄黒色素、四酸化三鉄紅色素、四酸化三鉄黄色素、デキストリン、二酸化ケイ素、フマル酸、モナスカス黄顔料などの補助原料はグミキャンデー剤形の届出類保健食品に使用不可となります。
上述した保健食品届出申請の流れ及び届出申請に所要な資料から見ると、保健食品登録申請に比べて、届出申請は毒理試験、効能試験を進行する必要がなくて、研究開発報告等の資料も要求しないので、保健食品の届出申請に対する技術要求は高くないとも言えます。ただし、輸入保健食品企業にとって、保健食品届出アカウントの申請及び製品の届出申請は以下の困難に遭遇する恐れがあります。
♦ 法規制へのしっかり把握:保健食品の届出に関する法規制が多くて、内容も複雑です。法規制を熟知している専門家だけは、法規制に対して全面的に理解して把握し、回り道を避けると思っております。
♦ 豊富な相関操作経験:アカウントの申請及び製品の届出申請に関する資料を準備する際に、法規制に明記される要求以外、法規制に説明されていない他の注意事項もあります。当局先生と常に交渉して、豊富な相関操作経験を持つ専門家だけが類似した注意事項に気づき、操作を把握できると思っております。
♦ 法規政策動向へのフォロー:一般的に、法規制の規定や要求は変わりません。ただし、ある細部の問題に対する要求について、当局先生は自分の評価経験に基づいて不定期的に細則化します。それに、関連した法規制もよく更新されますので、注意しなければなりません。CIRS食品法規事業部の専門家は法規政策の動向をフォローし、法規政策の変動があれば、即時に社内共有します。また、普段の対応に、当局先生の要求が変わると発見したら、すぐに全員周知いたします。できるだけ不必要な回り道を避けます。
♦ 企業連絡者に対する要求:企業連絡者は中国域内の携帯ナンバーを有しなければならなくて、中国語にも通じなければなりません。また、企業連絡者は当局先生の電話に出るだけではなくて、不必要な資料補充を避けるために当局先生と交渉して解釈することも必要です。従いまして、企業連絡者は保健食品の相関法規制及び提出された資料に対して熟知しなければなりません。
輸入保健食品の域外製造企業が上述した難点を乗り越えるために、相当な時間や費用が掛かるはずだと考えられます。従いまして、一般的に、輸入保健食品の域外製造企業は中国域内の申請代行機構に届出申請の諸事項を委託することになります。CIRSは保健食品登録申請及び保健食品届出申請に関わる法規制対応を提供することができます。何かお役に立てることがございましたら、どうぞ気軽にご相談ください。



