食品安全を確保するために、新食品原料が市場に参入する前に、安全性評価を行わなければならない。1983年、中国政府は新食品原料に対して初めて要求を公表し、1987年に関連した法規制を公表した。30年以上の発展に伴い、新食品原料の監督管理システムは完善され、数多くの新食品原料も認可され、各種類の食品に使用される。
1. 新食品原料の発展歴史
1987年から、新食品原料の管理は大きな変化を経ち、管理システムはますます完善されている。
表1 新食品原料の政策の発展歴史
時間 | 法規制 | 歴史名称 | 管理対象 | 管理方式及び変化 |
1987-1990 | 「食品新資源衛生管理弁法」 | 新資源食品 | 最終製品又は食品原料 | 80年代に公表されたもので、この時期の管理弁法の公告は遡られない。 |
1990.07.27-2007.11.30 | 「新資源食品衛生管理弁法」 | 新資源食品 | 最終製品又は食品原料 | I.公的認可を申請する前に、2年間の試製造を行わなければならない。 II.審査を通過した申請企業に許可証を発給する。 |
2007.12.01-2013.09.30 | 「新資源食品管理弁法」 | 新資源食品 | 食品原料 | I.試製造の制度をキャンセルする。 II.「食品原料」を管理対象として変更する。 III.同じな製品の重複審査を避けるために、最終許可証を申請企業のみに公布することではなく、ポジティブリストの形式で社会に公表する。 IV.「実質同等」の審査制度を開始する。 |
2013.10.01以後 | 「新食品原料安全審査管理弁法」 | 新食品原料 | 食品原料 | I.名称を「新資源食品」から「新食品原料」に変更し、新食品原料の範囲を再確定する。 II.申請資料として、中国リスク評価機構による作成した安全性評価報告との要求を追加する。 III.社会意見公募との審査プロセスを追加する。 |

図1 新食品原料の認可状況
1987年-2007年までの20年間、旧衛生部は総計344件の新資源食品を認可した。中に、最終製品の形式で認可された製品が多い。2年間の試製造を経って正式製造の製品として申請した製品は僅かな76件であり、認可総数の22%を占めす。
2007年12月1日から、「食品原料」は管理対象となった。今まで、総計128種の新食品原料は認可された。中に、動植物新原料は105件あり、微生物新原料は23件ある。
(認可された原料の詳細について、詳しくはCIRS新規食品原材料が中国に輸入許可ガイドを発表をクリックして確認してください。)
2. 新食品原料の応用
新食品原料は食品製造企業が新市場開拓の手段であり、認可されたら即時に各種類の食品に使用される。
2.1 一般食品領域の応用
新食品原料は魚油グミ飴、マカ固体飲料、ブルーベリールテインイースターキャンディー、アロエミルク飲料(アロエベラゲル)などの一般食品に広く使用されている。一般食品に認可された新食品原料を使用する場合、企業は下記の3点を注意しなければならない。
使用範囲
摂取量
ラベル、取扱書の要求
表2 新食品原料が一般食品に使用する場合の注意事項
例 | 公告の関連内容 | 注意事項 |
シアバター(Sheanut oil, Shea oil) | 使用範囲:チョコレート、キャンディー、アイスクリーム、ベーカリー製品に使用可能で、乳幼児用食品は除外する。 | l シアバターは列記される食品類別のみに使用可能。 l その他の食品類別(飲料など)に使用してはいけない。 |
マカパウダー | l 摂取量は毎日≤25g。 l 乳幼児、乳母、妊婦は適用除外者とする。 l 食品のラベル、取扱書に適用除外者と摂取制限量を表示しなければならない。 | l 製品の正味含有量、摂取方法などの状況に基づいてマカパウダーを適量に使用する。 l 製品のラベルに「当製品は○○gのマカパウダーを含有する。マカパウダーの摂取量は毎日≤25gで、乳幼児、乳母、妊婦は適用除外者とする」との情報を表示しなければならない。 |
2.2 健康食品領域の応用
CIRSのまとめによると、登録された健康食品によく使用される新食品原料は図2の通りである。図表から見ると、健康食品によく使用される新食品原料は脂質類原料と炭水化物類原料である。
又、健康食品登録を申請する時の手数を避けるために、新食品原料認可案を取得したメーカーから新食品原料を購入し、関連した認可文書を取得する健康食品企業が多い。
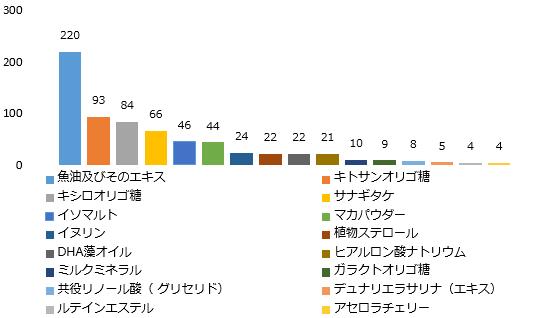
図2 健康食品によく使用される新食品原料の回数
2.3 特殊医学用途調整食品領域の応用
特殊医学用途調整食品(FSMP)に新食品原料を使用する場合、認可公告の要求に合致しなければならない。その同時に、特殊医学用途調整食品の食品安全国家標準及び関連した規定に合致しなければならない。
例 COPD病特定全栄養調整食品に魚油及びそのエキスを使用する場合は以下2点を注意しなければならない。
魚油及びそのエキスの品質は旧衛生部2009年第18号公告の要求に合致しなければならない。
魚油及びそのエキスの使用量は「GB29922に関する問題及び解答」に記載するn-3脂肪酸(EPAとDHA)の含有量に関する規定に基づいて適当に調整しなければならない。
目下、新食品原料は栄養補充(FSMPの本質)に役に立たなくて、又はFSMPに使用できない生物活性成分を含有することを原因として、FSMPに使用される新食品原料が少ない。新食品原料をFSMPの成分として使用しようとする場合、最も関心すべき問題はその栄養補充作用である。
(FSMPの原料使用について、詳しくは特殊医学用途調整食品の原料に関する分析をクリックして確認してください。)
3. 未来の発展
現在、中国国家食品安全リスク評価中心はタコノアシ、β-1,3-グルカン、ラクトバチルスヘルベティカスR0052、乳児ビフィドバクテリウムR0033、ビフィドバクテリウムビフィドゥムR0071などの新食品原料の認可草案を公表し、社会意見を募集している。今後はより多くの新食品原料が各種類の食品に使用されることを考えられる。
作者

于艷艷 食品安全及び法規事業部 技術マネージャー
浙江大学卒、食品工程専攻大学院生、食品技術、食品検測及び食品法規制の対応経験が豊富です。食品法規制のコンプライアンスに取り組み、国外企業の食品技術及びコンプライアンスに協力しております。
お問い合わせ



