2022年11月30日、欧州委員会(European Commission)は新条例((EU) 2022/2340)を公布し、欧州議会理事会(European Parliament and of the Council)第1925/2006号条例の附属書Ⅲを修訂し、没食子酸エピガロカテキン(Epigallocatechin gallate、EGCG)を含む緑茶エキスを食品制限リストに収載します。新条例は2022年12月21日から発効し、2023年6月21日以降、新条例の要求に合致しない相関製品は販売不能になります。
1. EGCGとは
発酵していない緑茶の中に「フラバノール(flavanol)」を含有し、一般的に、「カテキン (catechin)」と呼ばれます。そして、カテキンの中に最も重要的な成分はEGCGです。欧米において、カテキンは原材料としてサプリメントによく使用され、EGCGもその血脂調節、抗炎症、抗酸化などの機能で数多くの製造企業に好みます。

EGCGの化学構造式
2. 「EGCGを含む緑茶エキス」を食品制限リストに収載する原因
2015年の時、ノルウェー、スウェーデン、デンマークはカテキン(特に緑茶エキスに含有するEGCG)の摂取は潜在的なリスクあることを原因として、EUにそれを (EC) No 1925/2006附属書Ⅲ(当附属書に収載する物質は食品に使用禁止、制限使用、又は使用する前にEUに審査する必要)に収載することを提案しました。その後、EUは欧州食品安全機関(European Food Safety Authority、EFSA)に「緑茶カテキン」の安全性評価を行うことを要求しました。
2018年3月、EFSAは「緑茶カテキンの安全性科学意見」(EFSA ANS Panel, Younes M, Aggett P, et al. Scientific opinion on the safety of green tea catechins)を発表しました。当意見によりますと、EGCGの毎日摂取量が「≥800mg」の場合、血清トランスアミナーゼ向上を起こし、肝臓損傷になります。例え毎日摂取量が「<800mg」であっても、人体への危害も排除できません。
また、品種、栽培環境、製造工程、加工条件などの要素の影響で、伝統的な緑茶浸出液、溶解的な茶飲料、濃縮緑茶エキスを含むサプリメントなどの食品中のEGCG含有量は顕著的な差異があります。しかも、EGCG含有量と 肝臓参数異常の間の用量反応関係に相関するデータも少ないです。これらを原因として、EFSAは緑茶カテキンの安全的な食事摂取量を判定できません。最後、欧州委員会はEGCGを含む緑茶エキスを (EC) No 1925/2006附属書Ⅲに収載して管理します。相関する修訂内容は以下の通りです。
(1)附属書ⅢのB「制限物質リスト」に以下内容を新規追加
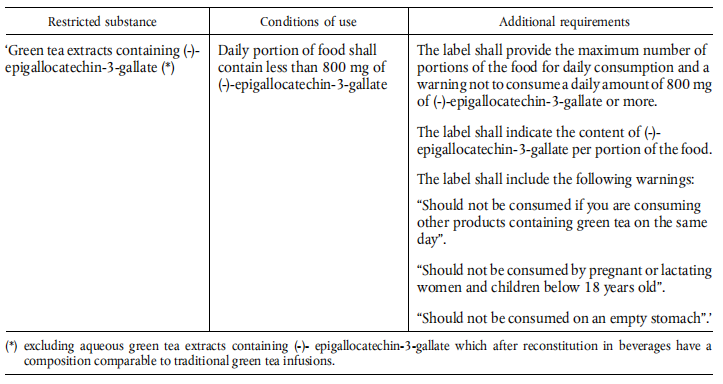
制限物質 | EGCGを含む緑茶エキス(※) |
使用条件 | 食品から摂取したEGCGは「<800mg/日」となる |
附属要求 | 1. ラベルに当食品の毎日最大食用件数を表記し、しかも、「EGCGの摂取量は『<800mg/日』となる」という警告内容も表記する必要。 2. ラベルに毎件の食品中のEGCG含有量を表記する必要。 3. ラベルに以下の警告内容を表記する必要。 ① 同日に他の緑茶含有製品を食用する場合、本製品を食用不可。 ② 妊婦、乳母、18歳以下の児童は食用不可。 ③ 空腹食用不可。 |
(2)附属書ⅢのC「審査必要な物質リスト」に以下内容を新規追加
EGCGを含む緑茶エキス(※)
(※):「EGCGを含む緑茶水抽出物」は含みません。当抽出物を飲料に溶解した後の成分は伝統的な緑茶浸出液と相当します。
3. まとめ
(EU) 2022/2340によりますと、本条例発効する前に既に市場販売している緑茶エキス含有食品は、もし、本条例の要求に合致しないなら、2023年6月21日以後に市場販売不可です。

由来:Official Journal of the European Union
今回の新条例は2022年12月21日から発効しました。不必要的な損失を避ける為に、相関企業は相関する製品ラベルを適時的に調整し、消費者への警告声明を徹底的に行うべきだと考えております。
一方、緑茶の葉から抽出した高度純化のEGCG(含有量≥90%)はいつもの通りに栄養強化剤とサプリメントに使用でき、本条例の対象ではありません。



