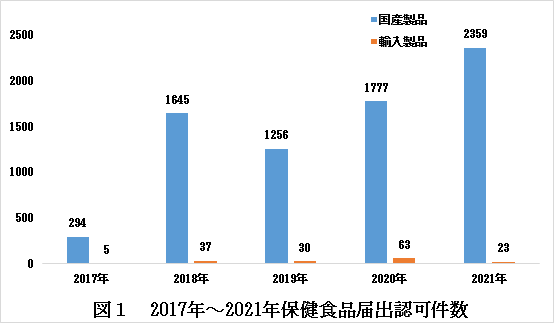
中国が2017年に保健食品届出管理制度を施行した以来、毎年、CIRSは中国届出類保健食品の認可状況をまとめて分析します。(「2021年届出類保健食品のまとめ」についてはこちらにてご確認ください)そして、中国国家市場監督管理総局(SAMR)及び各省レベル市場監督管理局のウェブサイトに開示される情報から見ると、輸入製品より、中国国産製品の届出認可件数はかなり多いです(詳しくは図1にてご確認ください)。
ですので、国産製品に比べて、どうして輸入製品の認可件数はこんなに少ないか、輸入製品の届出申請難度はかなり難しいではないかなどの疑問を抱いる外国企業も多いです。CIRSは多年の保健食品届出申請対応経験に基づき、輸入製品と国産製品が届出申請手続きにての区別を詳しく分析し、輸入保健食品届出申請する際の難点と注意事項を紹介します。
輸入製品と国産製品が届出申請手続きにての基本区別
項目 | 国産保健食品の届出申請 | 輸入保健食品の届出申請 |
管理部門 | 各省レベル市場監督管理局 | 中国国家市場監督管理総局(SAMR) |
申請企業資格要求 | 保健食品製造企業 | 外国食品関連会社 (製造企業でなくても可) |
届出申請可能な製品 | 「保健食品原料目録」に収載される原料を使用する保健食品。現時点は以下を含む。 1. ビタミン・ミネラルなどの栄養物質を補充する栄養素補助剤 2. コエンザイムQ10、壊れた壁霊芝胞子粉末、スピルリナ、魚油、メラトニンを単一原料とする保健食品 | 初回輸入のビタミン・ミネラルなどの栄養物質を補充する栄養素補助剤(サプリメント) |
まず、申請を主管する中国管理部門は違います。中国国産届出類保健食品なら、その申請審査・認可する部門は各省レベル地方市場監督管理局であり、その認可状況の公布は即時とも言えます。それに対し、輸入届出類保健食品の申請審査・認可する部門は中国国家市場監督管理総局(SAMR)であり、その認可状況の公布は少し遅滞だかもしれません。つまり、既に認可されましたが、SAMRウェブサイトに開示されていない輸入届出類保健食品もあります。また、SAMRは諸外国からの輸入製品の届出申請を審査しますので、作業量などの原因でその審査周期も少し長いかもしれません。
次に、申請企業に対する資格要求も違います。中国国産届出類保健食品なら、その申請企業は必ず製造企業でなければなりません。つまり、保健食品の実際製造企業だけが申請提出できます。それに対し、輸入届出類保健食品の届出申請は、類似した要求がありません。つまり、保健食品の実際製造企業でも、関連した企業(販売企業、輸入企業などの非製造企業)でも、何れも申請提出できます。
あと、輸入製品に比べて、届出申請可能な中国国産製品が使用可能な原料は多いです。SAMRは「保健食品原料目録」を何度拡大し、届出申請可能な製品の原料を増やしました。それに対し、中国食品最上位法律「中華人民共和国食品安全法」の表示と矛盾する原因で、現時点、届出申請可能な輸入製品が使用可能な原料は「保健食品原料目録」中のビタミン・ミネラルだけになり、他の機能性原料を選択してはいけません。
これからは、輸入届出類保健食品の申請流れを紹介します。
届出システムアカウント申請
国産保健食品も輸入保健食品も、製品の届出を申請する前に、申請企業はSAMRに届出システムアカウントを申請する必要です。その後の製品届出申請はこのシステムで提出します。届出申請の総周期を短縮する為に、システムアカウント申請の準備と製品届出申請の準備を同時に開始することお勧めします。こうすると、システムアカウントを取得した後、製品届出申請は即時的に提出できます。これは、最も迅速的な操作です。
中国企業と異なり、外国企業は届出システムアカウントを申請する際に以下三つの証明書類を提出する必要です。
- 製品製造国(地域)政府主管部門又は法律サービス機構より発行した申請企業が保健食品海外製造者であることを証明する資格証明書
- 連絡者授権書
- 申請企業法人代表パスポートのスキャン件
上述した証明書類を準備する時に、色々な細かい点を注意しなければなりません。例えば、申請企業の資格証明書及び連絡者授権書は中国大使館に公証・確認する必要です。
製品届出申請の所要資料
輸入製品届出申請の所要資料は国産製品と大体同じですが、国産製品より、輸入製品の届出申請は以下資料を追加提出する必要です。
輸入製品届出申請の追加資料
- 申請企業の製品製造国(地域)政府主管部門又は法律サービス機構より発行した申請企業が保健食品海外製造者であることを証明する資格証明書
- 申請する保健食品が製品製造国(地域)に1年以上の販売実績があることを証明する証明書
- 製品製造国(地域)又は国際組織が公布した保健食品製品の技術法規或は関連標準、製造品質管理体系の有効実行を証明できる製造企業自己検査報告、良好製造品質管理規範(GMP)に合致する証明資料
- 製品製造国(地域)に販売する製品パッケージ、ラベル、説明書の現物、及びそれぞれの中国語訳本と公証書
- 域外申請者の中国代表機構より届出申請事項を代理する場合、「外国企業常駐中国代表機構登記証」のスキャン件を提出する;域外申請者が中国国内代理機構を委託して届出申請事項を代理する場合、公証済みの委託書原本及び受託代理機構の営業許可書のスキャン件を提出する
外国企業にとって、上述した追加資料を準備する為に長い時間が掛かる必要です。
また、上述追加資料の発行機構に対する要求、或は資料発行する時の注意事項なども注意しなければなりません。さもないと、資料を繰り返し準備する恐れが高いです。そうすると、更に時間が掛かります。
まとめ:輸入保健食品届出申請の難点
関連した中国管理部門が開示される情報から見ると、輸入製品の届出認可件数と国産製品の届出認可件数は顕著的な差異が示します。その原因は色々があります。まず、輸入製品より、国産製品の申請件数はかなり多いです。それ以外、審査時間と公布周期などの影響もあると考えております。ただし、申請流れ、所要試験などの方面に、国産製品と輸入製品は大きな区別がありません。一方、輸入保健食品を届出申請する場合、システムアカウントの申請と製品の届出申請は、確実的に以下幾つの難点に遭遇する可能性があります。
- 中国法規制への深く理解
保健食品届出に関する法規制が多くて、その内容も複雑だとも言えます。法規制を熟知する技術専門家こそ、関連した法規制を全面的に把握でき、不必要な時間・作業も避けられます。
- 豊富的な実際操作経験
CIRSの経験に基づき、法規制に明記する要求以外、法規制に示していない細かい注意事項も多いです。届出申請に対して豊富的な経験を有し、しかも、SAMR審査センターの先生とよくコミュニケーションする技術専門家こそ、これらの細かいポイントを注意できます。
- 法規政策への即時フォロー
届出類保健食品の関連法規制はずっと更新し、申請資料に対してSAMR先生の要求も厳しくしています。CIRS食品事業部は法規制変動を随時フォローする専従者があり、また、普段の対応にSAMRの要求が変わったことを発見すれば、社内で即時周知することで、他のプロジェクトに不必要な時間・作業を避けられます。
外国企業が上述した難点を克服する為にかなりの時間とコストが必要だかもしれません。ですので、保健食品の届出申請事項を中国国内代理機構に委託することは最も適当的な方法です。CIRSは中国保健食品登録・届出申請代行の全般対応を提供することができます。何かお役に立てることがあれば、どうぞ、ご相談ください。
無料WEBセミナー:保健食品登録・届出に関する最新法規制及び申請操作の紹介 3/22(火)&3/23(水)

2022年3月22日と23日、CIRSは保健食品登録・届出に関する無料WEBセミナーを開催します。セミナーは4つの課題に分けて、3言語(中国語・日本語・英語)で保健食品の最新法規制及び申請操作を紹介します。ご参会、待っております。
第一講:中国保健食品最新法規制の紹介
第二講:輸入保健食品届出申請操作の紹介
第三講:保健食品登録申請の要点及び挑戦
第四講:保健食品ラベル表示の最新要求及びよくある誤り
参会方法などについて、詳しくはこちらにてご確認ください。
CIRSのサービス



